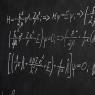إنشاء نظرية لهيكل المركبات العضوية. نظرية بنية المركبات العضوية
الكيمياء العضوية- فرع من فروع الكيمياء يدرس فيه مركبات الكربون وبنيتها وخصائصها وتحولاتها المتبادلة.
لقد نشأ اسم التخصص - "الكيمياء العضوية" - منذ وقت طويل. والسبب في ذلك يكمن في حقيقة أن معظم مركبات الكربون التي واجهها الباحثون في المرحلة الأولى من تطور العلوم الكيميائية كانت من أصل نباتي أو حيواني. ومع ذلك، كاستثناء، يتم تصنيف مركبات الكربون الفردية على أنها غير عضوية. على سبيل المثال، تعتبر أكاسيد الكربون وحمض الكربونيك والكربونات والبيكربونات وسيانيد الهيدروجين وبعض المواد الأخرى من المواد غير العضوية.
حاليا، هناك ما يقل قليلا عن 30 مليون مادة عضوية مختلفة، وهذه القائمة في تزايد مستمر. يرتبط هذا العدد الهائل من المركبات العضوية في المقام الأول بالخصائص المحددة التالية للكربون:
1) يمكن ربط ذرات الكربون ببعضها البعض في سلاسل ذات أطوال عشوائية؛
2) ليس من الممكن فقط الاتصال المتسلسل (الخطي) لذرات الكربون مع بعضها البعض، ولكن أيضًا اتصال متفرع وحتى دوري؛
3) من الممكن وجود أنواع مختلفة من الروابط بين ذرات الكربون، وهي الروابط المفردة والثنائية والثلاثية. علاوة على ذلك، فإن تكافؤ الكربون في المركبات العضوية يساوي دائمًا أربعة.
بالإضافة إلى ذلك، يتم تسهيل التنوع الكبير للمركبات العضوية أيضًا من خلال حقيقة أن ذرات الكربون قادرة على تكوين روابط مع ذرات العديد من العناصر الكيميائية الأخرى، على سبيل المثال، الهيدروجين والأكسجين والنيتروجين والفوسفور والكبريت والهالوجينات. في هذه الحالة، الهيدروجين والأكسجين والنيتروجين هي الأكثر شيوعا.
تجدر الإشارة إلى أن الكيمياء العضوية كانت لفترة طويلة بمثابة "غابة مظلمة" للعلماء. لبعض الوقت، كانت نظرية الحيوية شائعة في العلوم، والتي بموجبها لا يمكن الحصول على المواد العضوية "بشكل مصطنع"، أي. خارج المادة الحية ومع ذلك، فإن نظرية الحيوية لم تدم طويلا، ويرجع ذلك إلى حقيقة أنه تم اكتشاف المواد الواحدة تلو الأخرى التي يمكن تركيبها خارج الكائنات الحية.
لقد حير الباحثون من حقيقة أن العديد من المواد العضوية لها نفس التركيب النوعي والكمي، ولكن غالبًا ما يكون لها خصائص فيزيائية وكيميائية مختلفة تمامًا. على سبيل المثال، ثنائي ميثيل إيثر والكحول الإيثيلي لهما نفس التركيب العنصري تمامًا، ولكن في الظروف العادية يكون ثنائي ميثيل إيثر غازًا، والكحول الإيثيلي سائلًا. بالإضافة إلى ذلك، لا يتفاعل ثنائي ميثيل الأثير مع الصوديوم، لكن الكحول الإيثيلي يتفاعل معه، ويطلق غاز الهيدروجين.
طرح الباحثون في القرن التاسع عشر العديد من الافتراضات المتعلقة بكيفية تركيب المواد العضوية. تم طرح افتراضات مهمة للغاية من قبل العالم الألماني F. A. كيكولي، الذي كان أول من عبر عن فكرة أن ذرات العناصر الكيميائية المختلفة لها قيم تكافؤ محددة، وأن ذرات الكربون في المركبات العضوية رباعية التكافؤ وقادرة على الاتحاد مع بعضها البعض لتكوين السلاسل. في وقت لاحق، انطلاقا من افتراضات كيكولي، طور العالم الروسي ألكسندر ميخائيلوفيتش بتلروف نظرية حول بنية المركبات العضوية، والتي لم تفقد أهميتها في عصرنا. دعونا نفكر في الأحكام الرئيسية لهذه النظرية:
1) ترتبط جميع الذرات الموجودة في جزيئات المواد العضوية ببعضها البعض بتسلسل معين وفقًا لتكافؤها. تتمتع ذرات الكربون بتكافؤ ثابت قدره أربعة ويمكن أن تشكل سلاسل من هياكل مختلفة مع بعضها البعض؛
2) الخصائص الفيزيائية والكيميائية لأي مادة عضوية لا تعتمد فقط على تكوين جزيئاتها، ولكن أيضًا على الترتيب الذي ترتبط به الذرات في هذا الجزيء ببعضها البعض؛
3) تؤثر الذرات الفردية، وكذلك مجموعات الذرات الموجودة في الجزيء، على بعضها البعض. وينعكس هذا التأثير المتبادل في الخواص الفيزيائية والكيميائية للمركبات؛
4) من خلال دراسة الخواص الفيزيائية والكيميائية للمركب العضوي يمكن تحديد تركيبه. والعكس صحيح أيضًا - فمعرفة بنية جزيء مادة معينة، يمكنك التنبؤ بخصائصها.
تمامًا كما أصبح القانون الدوري لـ D. I. Mendelev هو الأساس العلمي للكيمياء غير العضوية، فإن نظرية بنية المواد العضوية التي كتبها A.M. أصبح بتليروف في الواقع نقطة البداية في تطوير الكيمياء العضوية كعلم. تجدر الإشارة إلى أنه بعد إنشاء نظرية بتلروف للبنية، بدأت الكيمياء العضوية في التطور بوتيرة سريعة جدًا.
الايزومرية والتماثل
ووفقا للموقف الثاني من نظرية بتليروف، فإن خصائص المواد العضوية لا تعتمد فقط على التركيب النوعي والكمي للجزيئات، ولكن أيضا على الترتيب الذي ترتبط به الذرات الموجودة في هذه الجزيئات ببعضها البعض.
وفي هذا الصدد فإن ظاهرة الأيزومرية منتشرة على نطاق واسع بين المواد العضوية.
الأيزومرية هي ظاهرة عندما يكون للمواد المختلفة نفس التركيب الجزيئي تمامًا، أي. نفس الصيغة الجزيئية.
في كثير من الأحيان، تختلف الأيزومرات بشكل كبير في الخصائص الفيزيائية والكيميائية. على سبيل المثال:
أنواع الايزومرية
الايزومرية الهيكلية
أ) الايزومرية للهيكل العظمي الكربوني
ب) الايزومرية الموضعية:
اتصال متعدد
النواب:
المجموعات الوظيفية:
ج) الايزومرية بين الطبقات:
تحدث الأيزومرية بين الطبقات عندما تنتمي المركبات التي تكون أيزومرات إلى فئات مختلفة من المركبات العضوية.
الايزومرية المكانية
الأيزومرية المكانية هي ظاهرة عندما تختلف المواد المختلفة التي لها نفس ترتيب ارتباط الذرات ببعضها البعض عن بعضها البعض من خلال موضع ثابت ومختلف للذرات أو مجموعات الذرات في الفضاء.
هناك نوعان من الأيزومرية المكانية - هندسية وبصرية. لم يتم العثور على مهام الأيزومرية الضوئية في امتحان الدولة الموحدة، لذلك سننظر في المهام الهندسية فقط.
إذا كان هناك رابطة أو حلقة مزدوجة C=C في جزيء المركب، ففي بعض الأحيان في مثل هذه الحالات تحدث ظاهرة هندسية أو رابطة الدول المستقلة العابرة-الايزومرية.
على سبيل المثال، هذا النوع من الأيزومرية ممكن بالنسبة للبوتين-2. معناها هو أن الرابطة المزدوجة بين ذرات الكربون لها في الواقع بنية مستوية، ويمكن أن تكون البدائل الموجودة على ذرات الكربون هذه موجودة بشكل ثابت إما فوق هذا المستوى أو أسفله:

عندما تكون البدائل المتطابقة على نفس الجانب من المستوى فإنهم يقولون ذلك رابطة الدول المستقلة- الأيزومر، وعندما تكون مختلفة - نشوة-أيزومر.
على شكل صيغ هيكلية رابطة الدول المستقلة-و نشوة-يتم تصوير الأيزومرات (باستخدام البيوتين -2 كمثال) على النحو التالي:
لاحظ أن الأيزومرية الهندسية مستحيلة إذا كانت ذرة كربون واحدة على الأقل في الرابطة المزدوجة تحتوي على بديلين متطابقين. لذلك، على سبيل المثال، رابطة الدول المستقلة عبرالأيزومرية غير ممكنة بالنسبة للبروبين:
 بروبين لا يملك رابطة الدول المستقلة العابرة- الأيزومرات، حيث أن إحدى ذرات الكربون في الرابطة المزدوجة لها "بدائل" متطابقتين (ذرات الهيدروجين)
بروبين لا يملك رابطة الدول المستقلة العابرة- الأيزومرات، حيث أن إحدى ذرات الكربون في الرابطة المزدوجة لها "بدائل" متطابقتين (ذرات الهيدروجين) كما ترون من الرسم التوضيحي أعلاه، إذا قمنا بتبديل الأماكن بين جذر الميثيل وذرة الهيدروجين الموجودة عند ذرة الكربون الثانية، على الجانبين المتقابلين من المستوى، فسنحصل على نفس الجزيء الذي نظرنا إليه للتو من الجانب الآخر.
تأثير الذرات ومجموعات الذرات على بعضها البعض في جزيئات المركبات العضوية
تم توسيع مفهوم التركيب الكيميائي كسلسلة من الذرات المتصلة ببعضها البعض بشكل كبير مع ظهور النظرية الإلكترونية. من وجهة نظر هذه النظرية، من الممكن شرح كيفية تأثير الذرات ومجموعات الذرات الموجودة في الجزيء على بعضها البعض.
هناك طريقتان محتملتان يؤثر بهما جزء من الجزيء على جزء آخر:
1) التأثير الاستقرائي
2) التأثير الميزوميري
تأثير حثي
لتوضيح هذه الظاهرة، دعونا نأخذ كمثال جزيء 1-كلوروبروبان (CH3CH2CH2Cl). الرابطة بين ذرات الكربون والكلور قطبية لأن الكلور له سالبية كهربية أعلى بكثير مقارنة بالكربون. نتيجة لانتقال كثافة الإلكترون من ذرة الكربون إلى ذرة الكلور، تتشكل شحنة موجبة جزئية (δ+) على ذرة الكربون، وتتكون شحنة سالبة جزئية (δ-) على ذرة الكلور:
غالبًا ما تتم الإشارة إلى التحول في كثافة الإلكترون من ذرة إلى أخرى بواسطة سهم يشير نحو الذرة الأكثر سالبية كهربية:
ومع ذلك، هناك نقطة مثيرة للاهتمام وهي أنه بالإضافة إلى التحول في كثافة الإلكترون من ذرة الكربون الأولى إلى ذرة الكلور، هناك أيضًا تحول، ولكن بدرجة أقل قليلاً، من ذرة الكربون الثانية إلى الأولى أيضًا. من الثالث إلى الثاني:
يُطلق على هذا التحول في كثافة الإلكترون على طول سلسلة من الروابط اسم التأثير الاستقرائي ( أنا). يتلاشى هذا التأثير مع المسافة من المجموعة المؤثرة ولا يظهر عمليا بعد روابط 3 σ.
في الحالة التي تكون فيها ذرة أو مجموعة ذرات لديها سالبية كهربية أكبر مقارنة بذرات الكربون، يقال أن هذه البدائل لها تأثير حثي سلبي (- أنا). وهكذا، في المثال الذي تمت مناقشته أعلاه، فإن ذرة الكلور لها تأثير حثي سلبي. بالإضافة إلى الكلور، فإن البدائل التالية لها تأثير حثي سلبي:
–F، –Cl، –Br، –I، –OH، –NH 2، –CN، –NO 2، –COH، –COOH
إذا كانت السالبية الكهربية لذرة أو مجموعة ذرات أقل من السالبية الكهربية لذرة الكربون، فإن هناك في الواقع انتقالًا لكثافة الإلكترون من هذه البدائل إلى ذرات الكربون. في هذه الحالة يقولون أن البديل له تأثير حثي إيجابي (+ أنا) (هو المانح للإلكترون).
لذلك، البدائل مع + أنا-التأثير هو الجذور الهيدروكربونية المشبعة. وفي الوقت نفسه، التعبير + أنا- يزداد التأثير مع استطالة الجذر الهيدروكربوني:
–CH 3 , –C 2 H 5 , –C 3 H 7 , –C 4 H 9
تجدر الإشارة إلى أن ذرات الكربون الموجودة في حالات التكافؤ المختلفة لها أيضًا سالبية كهربية مختلفة. تتمتع ذرات الكربون في الحالة المهجنة sp 2 بسالبية كهربية أكبر مقارنة بذرات الكربون في الحالة المهجنة sp 2، والتي بدورها تكون أكثر سالبية كهربية من ذرات الكربون في الحالة المهجنة sp 3.
التأثير المتوسطي (M)، أو تأثير الاقتران، هو تأثير البديل الذي ينتقل عبر نظام من روابط π المترافقة.
يتم تحديد علامة التأثير الميزومري وفقًا لنفس مبدأ علامة التأثير الحثي. إذا قام البديل بزيادة كثافة الإلكترون في نظام مترافق، فإنه يكون له تأثير ميزوميري إيجابي (+ م) وهو التبرع بالإلكترون. روابط كربون-كربون مزدوجة وبدائل تحتوي على زوج إلكترون وحيد: -NH 2 , -OH، الهالوجينات لها تأثير ميزوميري إيجابي.
التأثير الميزوميري السلبي (- م) لها بدائل تسحب كثافة الإلكترون من النظام المترافق، بينما تقل كثافة الإلكترون في النظام.
المجموعات التالية لها تأثير mesomeric سلبي:
–NO 2 , –COOH, –SO 3 H, –COH, >C=O
بسبب إعادة توزيع كثافة الإلكترون بسبب التأثيرات الميزومرية والحثية في الجزيء، تظهر شحنات جزئية موجبة أو سالبة على بعض الذرات، مما ينعكس على الخواص الكيميائية للمادة.
بيانياً، يظهر التأثير الميزوميري بواسطة سهم منحني يبدأ من مركز كثافة الإلكترون وينتهي حيث تتحول كثافة الإلكترون. على سبيل المثال، في جزيء كلوريد الفينيل، يحدث التأثير الميزوميري عندما يقترن زوج الإلكترون الوحيد لذرة الكلور بإلكترونات الرابطة π بين ذرات الكربون. وبالتالي، ونتيجة لذلك، تظهر شحنة موجبة جزئية على ذرة الكلور، وتنزاح سحابة الإلكترون المتنقلة، تحت تأثير زوج الإلكترون، نحو ذرة الكربون الخارجية، والتي تنشأ عليها شحنة سالبة جزئية كما يلي: نتيجة:
إذا كان الجزيء يحتوي على روابط مفردة ومزدوجة متناوبة، يقال أن الجزيء يحتوي على نظام إلكترون مترافق. من الخصائص المثيرة للاهتمام لهذا النظام أن التأثير الميزوميري فيه لا يتلاشى.
الكيمياء هو العلم الذي يمنحنا مجموعة متنوعة من المواد والأدوات المنزلية التي نستخدمها كل يوم دون تفكير. ولكن للوصول إلى اكتشاف مثل هذه المجموعة المتنوعة من المركبات المعروفة اليوم، كان على العديد من الكيميائيين أن يسلكوا طريقًا علميًا صعبًا.
العمل الضخم، والعديد من التجارب الناجحة وغير الناجحة، وقاعدة المعرفة النظرية الهائلة - كل هذا أدى إلى تشكيل مجالات مختلفة من الكيمياء الصناعية، وجعل من الممكن تجميع واستخدام المواد الحديثة: المطاط والبلاستيك والبلاستيك والراتنجات والسبائك والنظارات المختلفة والسيليكون وما إلى ذلك.
أحد أشهر علماء الكيمياء الذين قدموا مساهمة لا تقدر بثمن في تطوير الكيمياء العضوية كان الرجل الروسي إيه إم بتليروف. سننظر بإيجاز في أعماله ومزاياه ونتائجه في هذه المقالة.
سيرة ذاتية مختصرة
تاريخ ميلاد العالم هو سبتمبر 1828، ويختلف العدد باختلاف المصادر. كان نجل المقدم ميخائيل بتلروف. فقد والدته في وقت مبكر جدًا. عاش طفولته بأكملها في منزل عائلة جده، في قرية بودليسنايا شينتالا (إحدى مناطق جمهورية تتارستان الآن).
درس في أماكن مختلفة: أولا في مدرسة خاصة مغلقة، ثم في صالة الألعاب الرياضية. في وقت لاحق دخل جامعة قازان لدراسة الفيزياء والرياضيات. ومع ذلك، على الرغم من ذلك، كان أكثر اهتماما بالكيمياء. ظل المؤلف المستقبلي لنظرية بنية المركبات العضوية في مكانه كمدرس بعد التخرج.
1851 - وقت الدفاع عن أول أطروحة للعالم حول موضوع "أكسدة المركبات العضوية". وبعد أدائه الرائع، أتيحت له الفرصة لإدارة جميع أقسام الكيمياء في جامعته.

توفي العالم عام 1886 حيث أمضى طفولته في ملكية عائلة جده. تم دفنه في كنيسة العائلة المحلية.
مساهمة العالم في تطوير المعرفة الكيميائية
إن نظرية بتليروف حول بنية المركبات العضوية هي بالطبع عمله الرئيسي. ومع ذلك، ليس الوحيد. كان هذا العالم هو أول من أنشأ مدرسة الكيميائيين الروسية.
علاوة على ذلك، جاء من أسوارها هؤلاء العلماء الذين كان لهم فيما بعد ثقل كبير في تطوير كل العلوم. هؤلاء هم الأشخاص التاليين:
- ماركوفنيكوف.
- زايتسيف.
- كونداكوف.
- فافورسكي.
- كونوفالوف.
- لفوف وآخرون.
يعمل على الكيمياء العضوية
هناك العديد من هذه الأعمال التي يمكن تسميتها. بعد كل شيء، قضى بتليروف كل وقت فراغه تقريبًا في مختبر جامعته، حيث أجرى تجارب مختلفة، واستخلاص النتائج والاستنتاجات. هكذا ولدت نظرية المركبات العضوية.
هناك العديد من الأعمال الرحيبة بشكل خاص للعالم:
- قام بإنشاء تقرير لمؤتمر حول موضوع "في التركيب الكيميائي للمادة"؛
- عمل أطروحة "على الزيوت الأساسية"؛
- أول عمل علمي "أكسدة المركبات العضوية".
قبل صياغتها وإنشائها، قام مؤلف نظرية بنية المركبات العضوية بدراسة أعمال علماء آخرين من مختلف البلدان لفترة طويلة، وفحص أعمالهم، بما في ذلك الأعمال التجريبية. عندها فقط، تعميم وتنظيم المعرفة المكتسبة، يعكس جميع الاستنتاجات في أحكام نظريته الشخصية.

نظرية بنية المركبات العضوية بقلم A. M. Butlerov
تميز القرن التاسع عشر بالتطور السريع في جميع العلوم تقريبًا، بما في ذلك الكيمياء. وعلى وجه الخصوص، تستمر الاكتشافات واسعة النطاق بشأن الكربون ومركباته في التراكم وتدهش الجميع بتنوعها. ومع ذلك، لا يجرؤ أحد على تنظيم وتنظيم كل هذه المواد الواقعية، وإيصالها إلى قاسم مشترك وتحديد الأنماط المشتركة التي يُبنى عليها كل شيء.
كان بتلروف إيه إم هو أول من امتلك النظرية البارعة للتركيب الكيميائي للمركبات العضوية، والتي تحدث بأحكامها بشكل جماعي في المؤتمر الألماني للكيميائيين. وكانت هذه بداية حقبة جديدة في تطور العلوم، حيث دخلت الكيمياء العضوية
لقد اقترب العالم نفسه من هذا تدريجياً. أجرى العديد من التجارب وتنبأ بوجود مواد ذات خصائص معينة، واكتشف أنواعًا معينة من التفاعلات ورأى المستقبل وراءها. لقد درست الكثير من أعمال زملائي واكتشافاتهم. فقط على هذه الخلفية، من خلال العمل الدقيق والمضني، تمكن من إنشاء تحفة له. والآن نظرية بنية المركبات العضوية في هذا هو عمليا نفس الجدول الدوري في غير العضوية.

اكتشافات العلماء قبل إنشاء النظرية
ما هي الاكتشافات التي تم التوصل إليها والمبررات النظرية التي قدمها العلماء قبل ظهور نظرية أ.م.بتليروف حول بنية المركبات العضوية؟
- كان العبقري المحلي أول من قام بتصنيع مواد عضوية مثل الميثينامين والفورمالديهايد ويوديد الميثيلين وغيرها.
- لقد قام بتصنيع مادة شبيهة بالسكر (الكحول الثلاثي) من مواد غير عضوية، مما وجه ضربة أخرى لنظرية الحيوية.
- وتنبأ بمستقبل تفاعلات البلمرة ووصفها بأنها الأفضل والأكثر واعدة.
- تم شرح الأيزومرية لأول مرة من قبله فقط.
وبطبيعة الحال، هذه ليست سوى المعالم الرئيسية لعمله. في الواقع، يمكن وصف سنوات عديدة من العمل المضني للعالم بإسهاب. ومع ذلك، أصبحت نظرية بنية المركبات العضوية هي الأكثر أهمية اليوم، والتي سنناقش أحكامها أكثر.
الموقف الأول من النظرية
في عام 1861، شارك العالم الروسي الكبير، في مؤتمر للكيميائيين في مدينة شباير، مع زملائه آراءه حول أسباب بنية وتنوع المركبات العضوية، معبرًا عن كل ذلك في شكل مبادئ نظرية.
النقطة الأولى هي ما يلي: جميع الذرات الموجودة في جزيء واحد مرتبطة بتسلسل صارم، والذي يتم تحديده من خلال تكافؤها. في هذه الحالة، تظهر ذرة الكربون مؤشر تكافؤ قدره أربعة. الأكسجين لديه قيمة هذا المؤشر تساوي اثنين، الهيدروجين - واحد.
واقترح تسمية هذه الميزة الكيميائية لاحقًا، وتم اعتماد الرموز للتعبير عنها على الورق باستخدام الصيغ الهيكلية والمختصرة والجزيئية الكاملة.

ويشمل ذلك أيضًا ظاهرة اتحاد جزيئات الكربون مع بعضها البعض في سلاسل لا نهاية لها من هياكل مختلفة (خطية، دورية، متفرعة).
بشكل عام، حددت نظرية بتليروف في بنية المركبات العضوية، بموقفها الأول، أهمية التكافؤ وصيغة واحدة لكل مركب، تعكس خواص المادة وسلوكها أثناء التفاعلات.
الموقف الثاني من النظرية
وفي هذه المرحلة تم تقديم شرح لتنوع المركبات العضوية في العالم. واستنادا إلى مركبات الكربون الموجودة في السلسلة، أعرب العالم عن فكرة أن هناك مركبات مختلفة في العالم لها خصائص مختلفة، ولكنها متطابقة تماما في التركيب الجزيئي. وبعبارة أخرى، هناك ظاهرة الايزومرية.
من خلال هذا الاقتراح، لم تشرح نظرية A. M. Butlerov حول بنية المركبات العضوية جوهر الأيزومرات والإيزومرية فحسب، بل أكد العالم نفسه كل شيء من خلال الخبرة العملية.
على سبيل المثال، قام بتصنيع أيزومر البيوتان - الأيزوبيوتان. ثم تنبأ بوجود ليس واحدًا، بل ثلاثة أيزومرات للبنتان، بناءً على بنية المركب. وقام بتجميعها جميعًا، مثبتًا أنه كان على حق.

فتح المركز الثالث
النقطة التالية من النظرية تقول أن جميع الذرات والجزيئات الموجودة في المركب الواحد قادرة على التأثير على خصائص بعضها البعض. وسوف تعتمد على ذلك طبيعة سلوك المادة في التفاعلات بأنواعها المختلفة، وكذلك الخواص الكيميائية وغيرها من الخصائص المعروضة.
وبالتالي، على أساس هذا الحكم، يتم تمييز العديد من المجموعات المحددة الوظيفية، والتي تختلف في المظهر والبنية.
تم تقديم نظرية بنية المركبات العضوية التي كتبها A. M. Butlerov بإيجاز في جميع الكتب المدرسية تقريبًا عن الكيمياء العضوية. ففي نهاية المطاف، هذا هو بالتحديد أساس هذا القسم، وهو شرح لجميع الأنماط التي تُبنى عليها الجزيئات.
أهمية النظرية في العصر الحديث
بالطبع إنه أمر عظيم. سمحت هذه النظرية بما يلي:
- الجمع بين جميع المواد الواقعية المتراكمة وقت إنشائها وتنظيمها؛
- شرح أنماط التركيب وخصائص المركبات المختلفة؛
- تقديم شرح كامل لأسباب هذا التنوع الكبير في المركبات في الكيمياء؛
- أدى إلى ظهور العديد من توليفات المواد الجديدة بناء على مبادئ النظرية؛
- سمح للآراء بالتقدم وتطوير التدريس الذري الجزيئي.
لذلك، فإن القول بأن مؤلف نظرية بنية المركبات العضوية، الذي يمكن رؤية صورته أدناه، فعل الكثير هو عدم قول أي شيء. يمكن اعتبار بتلروف بحق والد الكيمياء العضوية، مؤسس أسسها النظرية.
لعبت رؤيته العلمية للعالم وعبقرية التفكير وقدرته على توقع النتيجة دورًا في التحليل النهائي. كان هذا الرجل يتمتع بقدرة هائلة على العمل والصبر، وكان يجرب ويركب ويتدرب بلا كلل. لقد ارتكبت أخطاء، لكنني تعلمت دائمًا درسًا وتوصلت إلى الاستنتاجات الصحيحة على المدى الطويل.

فقط هذه المجموعة من الصفات والفطنة التجارية والمثابرة جعلت من الممكن تحقيق التأثير المطلوب.
دراسة الكيمياء العضوية في المدرسة
في دورة التعليم الثانوي، لا يتم تخصيص الكثير من الوقت لدراسة أساسيات المواد العضوية. ربع الصف التاسع فقط والسنة الكاملة للصف العاشر (وفقًا لبرنامج O. S. Gabrielyan). ومع ذلك، هذه المرة كافية للأطفال ليتمكنوا من دراسة جميع الفئات الرئيسية للمركبات، وخصائص تركيبها وتسمياتها، وأهميتها العملية.
الأساس للبدء في إتقان الدورة هو نظرية بنية المركبات العضوية التي كتبها A. M. Butlerov. ويخصص الصف العاشر للنظر الكامل في أحكامه، ومن ثم لتأكيدها نظريا وعمليا في دراسة كل فئة من المواد.
ظهر الأول في بداية القرن التاسع عشر. نظرية جذرية(ج. جاي لوساك، ف. ويهلر، ج. ليبيج). الجذور هي مجموعات من الذرات التي تنتقل دون تغيير أثناء التفاعلات الكيميائية من مركب إلى آخر. لقد تم الحفاظ على مفهوم المتطرفين هذا، ولكن تبين أن معظم الأحكام الأخرى لنظرية المتطرفين غير صحيحة.
وفق نظريات النوع(سي جيرارد) يمكن تقسيم جميع المواد العضوية إلى أنواع تتوافق مع بعض المواد غير العضوية. على سبيل المثال، تعتبر الكحولات R-OH والإيثرات R-O-R ممثلين لنوع الماء H-OH، حيث يتم استبدال ذرات الهيدروجين بالجذور. خلقت نظرية الأنواع تصنيفًا للمواد العضوية، والتي تُستخدم بعض مبادئها اليوم.
تم إنشاء النظرية الحديثة لتركيب المركبات العضوية بواسطة العالم الروسي المتميز أ.م. بتليروف.
المبادئ الأساسية لنظرية بنية المركبات العضوية أ.م. بتليروف
1. يتم ترتيب الذرات في الجزيء بتسلسل معين حسب تكافؤها. تكافؤ ذرة الكربون في المركبات العضوية هو أربعة.
2. لا تعتمد خصائص المواد فقط على الذرات والكميات الموجودة في الجزيء، ولكن أيضًا على ترتيب ارتباطها ببعضها البعض.
3. الذرات أو مجموعات الذرات التي تشكل الجزيء تؤثر بشكل متبادل على بعضها البعض، مما يحدد النشاط الكيميائي وتفاعلية الجزيئات.
4. دراسة خصائص المواد تسمح لنا بتحديد تركيبها الكيميائي.
يعد التأثير المتبادل للذرات المجاورة في الجزيئات من أهم خصائص المركبات العضوية. وينتقل هذا التأثير إما من خلال سلسلة من الروابط البسيطة أو من خلال سلسلة من الروابط البسيطة والمزدوجة (المتناوبة).
تصنيف المركبات العضويةيعتمد على تحليل جانبين من بنية الجزيئات - بنية الهيكل العظمي للكربون ووجود المجموعات الوظيفية.
المركبات العضوية
الهيدروكربونات مركبات حلقية غير متجانسة
الحد- غير مسبوق- رائحة-
عملية فعالة
الأليفاتية الكربونية الحلقية
في نهاية المطاف العطرية الحلقية غير المشبعة
(الألكانات) (الألكانات الحلقية) (الساحات)
مع نح 2 ن+2 ج نح 2 نمع نح 2 ن-6
نهاية العمل -
هذا الموضوع ينتمي إلى القسم:
مقدمة. أساسيات النظرية الحديثة للهيكل
المركبات العضوية.. مقدمة.. تدرس الكيمياء العضوية الحيوية بنية وخصائص المواد المشاركة في العمليات الحيوية في..
إذا كنت بحاجة إلى مواد إضافية حول هذا الموضوع، أو لم تجد ما كنت تبحث عنه، نوصي باستخدام البحث في قاعدة بيانات الأعمال لدينا:
ماذا سنفعل بالمواد المستلمة:
إذا كانت هذه المادة مفيدة لك، فيمكنك حفظها على صفحتك على الشبكات الاجتماعية:
| سقسقة |
جميع المواضيع في هذا القسم:
الألكينات الكاديينات الألكينات
SpN2p SpN2p-2 SpN2p-2 الشكل. 1. تصنيف المركبات العضوية حسب البنية
التركيب الالكتروني لذرة الكربون. تهجين.
بالنسبة لطبقة إلكترون التكافؤ لذرة C، الموجودة في المجموعة الفرعية الرئيسية للمجموعة الرابعة من الفترة الثانية من الجدول الدوري لـ D. I. Mendeleev، رقم الكم الرئيسي n = 2، الثانوي (المداري
الأنظمة المترافقة
هناك نوعان من الأنظمة المترافقة (والوصلات).
1. p، p-اقتران - يتم إلغاء تمركز الإلكترونات
ايزومرية المركبات العضوية.
إذا كانت مادتان منفردتان أو أكثر لهما نفس التركيب الكمي (الصيغة الجزيئية)، لكنهما تختلفان عن بعضهما البعض في
مطابقة الجزيئات العضوية
يعد الدوران حول الرابطة C–C سهلًا نسبيًا، ويمكن أن تتخذ السلسلة الهيدروكربونية أشكالًا مختلفة. تتحول الأشكال المطابقة بسهولة إلى بعضها البعض وبالتالي فهي ليست مركبات مختلفة
تطابقات المركبات الحلقية.
السيكلوبنتان. الحلقة المكونة من خمسة أعضاء ذات الشكل المسطح لها زوايا ترابط تبلغ 108°، وهي قريبة من القيمة الطبيعية لذرة هجينة sp3. لذلك، في السيكلوبنتان المسطح، على عكس الدورة
ايزومرات التكوين
وهي عبارة عن متصاوغات مجسمة ذات ترتيبات مختلفة حول ذرات معينة من ذرات أخرى أو جذور أو مجموعات وظيفية في الفضاء بالنسبة لبعضها البعض.
هناك مفاهيم الانزعاج
الخصائص العامة لتفاعلات المركبات العضوية.
الحموضة والقاعدية للمركبات العضوية.
لتقييم حموضة وقاعدية المركبات العضوية، هناك نظريتان لهما أهمية قصوى - نظرية برونستد والثيو
قواعد برونستد هي جزيئات أو أيونات محايدة يمكنها قبول البروتون (متقبلات البروتون).
الحموضة والقاعدية ليستا مطلقتين، ولكن الخواص النسبية للمركبات: الخواص الحمضية توجد فقط في وجود القاعدة؛ الخصائص الأساسية - فقط في وجود كي
الخصائص العامة لتفاعلات المركبات العضوية
تتضمن معظم التفاعلات العضوية عدة خطوات متسلسلة (أولية). ويسمى الوصف التفصيلي لمجموع هذه المراحل بالآلية. آلية التفاعل -
انتقائية ردود الفعل
في كثير من الحالات، يحتوي المركب العضوي على عدة مراكز تفاعل غير متساوية. اعتمادًا على بنية منتجات التفاعل، يتحدثون عن الانتقائية الإقليمية والانتقائية الكيميائية و
ردود فعل جذرية.
يتفاعل الكلور مع الهيدروكربونات المشبعة فقط تحت تأثير الضوء أو الحرارة أو في وجود المحفزات، ويتم استبدال جميع ذرات الهيدروجين تباعاً بالكلور: CH4
تفاعلات الإضافة الكهربية
تفاعلات الاستبدال النيوكليوفيلية التي تتضمن ذرة الكربون المهجنة sp2.
دعونا نفكر في آلية التفاعلات من هذا النوع باستخدام مثال تفاعل الأحماض الكربوكسيلية مع الكحوليات (تفاعل الأسترة). في مجموعة الكربوكسيل للحمض، يحدث اقتران p،p، لأن الزوج يكون
تفاعلات الاستبدال النيوكليوفيلية في سلسلة الأحماض الكربوكسيلية.
فقط من وجهة نظر رسمية بحتة يمكن اعتبار مجموعة الكربوكسيل بمثابة مزيج من وظائف الكربونيل والهيدروكسيل. في الواقع، تأثيرهم المتبادل على بعضهم البعض هو تماما و
المركبات العضوية.
تحتل تفاعلات الأكسدة والاختزال (ORR) مكانًا كبيرًا في الكيمياء العضوية. OVR له أهمية قصوى لعمليات الحياة. بمساعدتهم سوف يرضي الجسم
المشاركة في العمليات الحياتية
الغالبية العظمى من المواد العضوية المشاركة في عمليات التمثيل الغذائي هي مركبات تحتوي على مجموعتين وظيفيتين أو أكثر. عادة ما يتم تصنيف هذه المركبات
الفينولات ثنائية الذرة
الفينولات ثنائية الذرة - البيروكاتيكول، والريسورسينول، والهيدروكينون - جزء من العديد من المركبات الطبيعية. كل منهم يعطي تلطيخ مميز بكلوريد الحديديك. بيروكاتيكول (o-ثنائي هيدروكسي بنزين، كاتيشو
الأحماض الكربوكسيلية ثنائية الكربوكسيل وغير المشبعة.
تسمى الأحماض الكربوكسيلية التي تحتوي على مجموعة كربوكسيل واحدة أحادية القاعدة، وتسمى اثنتين منها ثنائية القاعدة، وما إلى ذلك. الأحماض الثنائية الكربوكسيل هي مواد بلورية بيضاء تحتوي على
الكحولات الأمينية
2-أمينوإيثانول (الإيثانول أمين، الكولامين) هو مكون هيكلي للدهون المعقدة، التي تتشكل عن طريق فتح الحلقات الثلاثية المتوترة من أكسيد الإيثيلين والإيثيلينيمين مع الأمونيا أو الماء، على التوالي.
الهيدروكسي والأحماض الأمينية.
تحتوي أحماض الهيدروكسي على مجموعتي الهيدروكسيل والكربوكسيل في الجزيء، بينما تحتوي الأحماض الأمينية على مجموعتي الكربوكسيل والأمينية.
حسب موقع مجموعة الهيدروكسي أو الأمينو
الأحماض الأكسية
الأحماض الأوكسية هي مركبات تحتوي على مجموعتي الكربوكسيل والألدهيد (أو الكيتون). وفقا لهذا، يتم تمييز أحماض الألدهيد وأحماض الكيتو.
أبسط حمض ألدهيد
مشتقات البنزين غير المتجانسة كأدوية.
المركبات الحلقية غير المتجانسة (الحلقات غير المتجانسة) هي مركبات تتضمن ذرة واحدة أو أكثر غير الكربون (الذرات غير المتجانسة) في الدورة. الأنظمة الحلقية غير المتجانسة تكمن وراء ذلك
الموضوع 11. الأحماض الأمينية والببتيدات والبروتينات
هيكل وخصائص الأحماض الأمينية والببتيدات.
الأحماض الأمينية هي مركبات توجد في جزيئاتها مجموعات أمينية وكربوكسيلية في وقت واحد. أمين طبيعي
التركيب المكاني للبوليبيبتيدات والبروتينات
تتميز البوليبتيدات والبروتينات ذات الوزن الجزيئي العالي، إلى جانب البنية الأولية، بمستويات أعلى من التنظيم، والتي تسمى عادةً الهياكل الثانوية والثالثية والرباعية.
الموضوع 12. الكربوهيدرات: السكريات الأحادية والثنائية والسكريات المتعددة
تنقسم الكربوهيدرات إلى بسيطة (السكريات الأحادية) ومعقدة (السكريات المتعددة).
السكريات الأحادية (أحادية). هذه مركبات متعددة الوظائف تحتوي على الكربونيل وعدة جرامات
الموضوع 13. النيوكليوتيدات والأحماض النووية
الأحماض النووية (بولينوكليوتيدات) هي بوليمرات حيوية وحداتها المونومرية هي نيوكليوتيدات.
النوكليوتيدات عبارة عن هيكل مكون من ثلاثة مكونات
النيوكليوسيدات.
تشكل القواعد الحلقية غير المتجانسة N- جليكوسيدات مع D-ribose أو 2-deoxy-D-ribose. في كيمياء الحمض النووي، تسمى جليكوسيدات N هذه بالنيوكليوسيدات. D-ribose و 2-deoxy-D-ribose في ص
النيوكليوتيدات.
تسمى النيوكليوتيدات بفوسفات النيوكليوسيدات. يقوم حمض الفوسفوريك عادة باسترة هيدروكسيل الكحول عند C-5" أو C-3" في بقايا الريبوز أو الديوكسيريبوز (يتم ترقيم ذرات الحلقة الأساسية النيتروجينية
المنشطات
يتم توزيع المنشطات على نطاق واسع في الطبيعة وتؤدي مجموعة متنوعة من الوظائف في الجسم. حتى الآن، تم التعرف على حوالي 20.000 نوع من المنشطات؛ ويستخدم أكثر من 100 منهم في الطب. المنشطات لديها
هرمونات الستيرويد
الهرمونات هي مواد نشطة بيولوجيا تتشكل نتيجة لنشاط الغدد الصماء وتشارك في تنظيم عملية التمثيل الغذائي والوظائف الفسيولوجية في الجسم.
الجامدة
وكقاعدة عامة، تكون الخلايا غنية جدًا بالستيرول. اعتمادا على مصدر العزلة، يتم تمييز زوستيرولس (من الحيوانات)، فيتوسترولس (من النباتات)، ميكوسترولس (من الفطريات) وستيرول الكائنات الحية الدقيقة. في
يجمع هذا الاسم بين عدد من الهيدروكربونات ومشتقاتها المحتوية على الأكسجين - الكحوليات والألدهيدات والكيتونات، والتي يتكون هيكلها الكربوني من وحدتين أو ثلاث وحدات إيزوبرين أو أكثر. سامي
الفيتامينات
تسمى الفيتامينات عادةً بالمواد العضوية التي يعد وجودها بكميات صغيرة في طعام البشر والحيوانات ضروريًا لعملهم الطبيعي.
هذه عملية كلاسيكية.
الفيتامينات القابلة للذوبان في الدهون
فيتامين أ هو سيسكويتيربين ويوجد في الزبدة والحليب وصفار البيض وزيت السمك. لا تحتوي على شحم الخنزير والسمن. هذا هو فيتامين النمو. ونقصه في الغذاء يسبب
الفيتامينات القابلة للذوبان في الماء
وفي نهاية القرن الماضي، عانى آلاف البحارة على متن السفن اليابانية، وتوفي الكثير منهم موتًا مؤلمًا بسبب مرض البري بري الغامض. أحد ألغاز مرض البري بري هو أن البحارة كانوا على متن السفينة
الكيمياء والصيدلة
تحميل العمل
بحلول الستينيات من القرن الماضي، تراكمت الكيمياء العضوية كمية هائلة من المواد الواقعية التي تتطلب تفسيرا. على خلفية التراكم المستمر للحقائق التجريبية، كان قصور المفاهيم النظرية للكيمياء العضوية حادا بشكل خاص. لقد تأخرت النظرية عن الممارسة والتجربة. وكان لهذا التأخر أثر مؤلم على تقدم الأبحاث التجريبية في المختبرات؛ أجرى الكيميائيون أبحاثهم بشكل عشوائي إلى حد كبير، وبشكل أعمى، وفي كثير من الأحيان دون فهم طبيعة المواد التي قاموا بتصنيعها وجوهر التفاعلات التي أدت إلى تكوينها. الكيمياء العضوية، كما قال فولر على نحو مناسب، تشبه غابة كثيفة مليئة بالأشياء الرائعة، غابة ضخمة ليس لها مخرج ولا نهاية. "الكيمياء العضوية مثل غابة كثيفة، من السهل الدخول إليها ولكن من المستحيل الخروج منها." لذا، على ما يبدو، كان مقدرًا أن تكون قازان هي التي أعطت العالم بوصلة لا يخيفها الدخول إلى "الغابة الكثيفة للكيمياء العضوية". وهذه البوصلة، التي لا تزال تُستخدم حتى اليوم، هي نظرية بتلروف في التركيب الكيميائي. منذ الستينيات من القرن الماضي وحتى يومنا هذا، يبدأ أي كتاب مدرسي في العالم عن الكيمياء العضوية بافتراضات نظرية الكيميائي الروسي العظيم ألكسندر ميخائيلوفيتش بتلروف.
المبادئ الأساسية لنظرية التركيب الكيميائيأكون. بتليروف
المركز الأول
ترتبط الذرات الموجودة في الجزيئات ببعضها البعض بتسلسل معين وفقًا لتكافؤها. يُطلق على تسلسل الروابط بين الذرات في الجزيء تركيبه الكيميائي وينعكس بصيغة هيكلية واحدة (صيغة البنية).
ينطبق هذا الحكم على بنية جزيئات جميع المواد. في جزيئات الهيدروكربونات المشبعة، تتحد ذرات الكربون مع بعضها البعض لتشكل سلاسل. في هذه الحالة، يتم ملاحظة رباعي التكافؤ لذرات الكربون وأحادية ذرات الهيدروجين بدقة.
المركز الثاني. لا تعتمد خصائص المواد على تركيبها النوعي والكمي فحسب، بل تعتمد أيضًا على ترتيب ارتباط الذرات في الجزيء(ظاهرة الايزومرية).
دراسة بنية جزيئات الهيدروكربون، جاء A. M. Butlerov إلى استنتاج مفاده أن هذه المواد، بدءا من البيوتان (C 4 ن 10 ) ، من الممكن ترتيب مختلف لربط الذرات بنفس تركيبة الجزيئات، وبالتالي، في البوتان، من الممكن ترتيب مزدوج لذرات الكربون: في شكل سلسلة مستقيمة (غير متفرعة) ومتفرعة.
هذه المواد لها نفس الصيغة الجزيئية، ولكن الصيغ الهيكلية مختلفة وخصائص مختلفة (نقطة الغليان). لذلك، هذه مواد مختلفة. وتسمى هذه المواد الايزومرات.
والظاهرة التي يمكن أن توجد فيها عدة مواد لها نفس التركيب ونفس الوزن الجزيئي، ولكنها تختلف في التركيب الجزيئي والخصائص، تسمى الظاهرةالأيزومرية. علاوة على ذلك، مع زيادة عدد ذرات الكربون في جزيئات الهيدروكربون، يزداد عدد الأيزومرات. على سبيل المثال، هناك 75 أيزومرات (مواد مختلفة) تتوافق مع الصيغة C 10 ن 22 و 1858 أيزومرات بالصيغة C 14 ن 30 .
للتركيب C5H12 يمكن أن توجد الأيزومرات التالية (هناك ثلاثة منها) -


المركز الثالث. بناءً على خصائص مادة معينة، يمكن تحديد بنية جزيئها، وبناءً على بنيتها، يمكن التنبؤ بخصائصها.إثبات هذا الطرح يمكن إثبات هذا الطرح باستخدام مثال الكيمياء غير العضوية.
مثال. إذا كانت هذه المادة تغير لون عباد الشمس البنفسجي إلى اللون الوردي، وتتفاعل مع المعادن التي تقف قبل الهيدروجين، مع الأكاسيد الأساسية، والقواعد، فيمكننا أن نفترض أن هذه المادة تنتمي إلى فئة الأحماض، أي. يحتوي على ذرات هيدروجين وبقايا حمض. وعلى العكس من ذلك، إذا كانت هذه المادة تنتمي إلى فئة الأحماض، فإنها تظهر الخصائص المذكورة أعلاه. على سبيل المثال: ن 2 س 4 - حامض الكبريتيك
المركز الرابع. الذرات ومجموعات الذرات الموجودة في جزيئات المواد تؤثر بشكل متبادل على بعضها البعض.
دليل على هذه النقطة
يمكن إثبات هذا الموقف باستخدام مثال الكيمياء غير العضوية. للقيام بذلك، نحن بحاجة إلى مقارنة خصائص المحاليل المائيةنه 3، HC1، ن 2 يا (عمل المؤشر). وفي الحالات الثلاث تحتوي المواد على ذرات هيدروجين، ولكنها مرتبطة بذرات مختلفة، والتي لها تأثيرات مختلفة على ذرات الهيدروجين، وبالتالي تختلف خواص المواد.
كانت نظرية بتليروف هي الأساس العلمي للكيمياء العضوية وساهمت في تطورها السريع. واستنادا إلى أحكام النظرية، أ.م. وأوضح بتلروف ظاهرة الأيزومرية، وتنبأ بوجود أيزومرات مختلفة وحصل على بعضها لأول مرة.
في خريف عام 1850، اجتاز بتلروف امتحانات درجة الماجستير في الكيمياء وبدأ على الفور أطروحة الدكتوراه "حول الزيوت الأساسية"، والتي دافع عنها في أوائل العام المقبل.

في 17 فبراير 1858، قدم بتليروف تقريرًا في الجمعية الكيميائية بباريس، حيث أوجز لأول مرة أفكاره النظرية حول بنية المادة، وأثار تقريره اهتمامًا عامًا ونقاشًا حيويًا: "إن قدرة الذرات على التواصل مع بعضها البعض مختلفة . ومن المثير للاهتمام بشكل خاص في هذا الصدد الكربون، الذي، وفقًا لأوغست كيكولي، رباعي التكافؤ.
لم يعبر أحد عن مثل هذه الأفكار حتى الآن. وتابع بتلروف: ربما حان الوقت الذي يجب أن يصبح فيه بحثنا أساسًا لنظرية جديدة للتركيب الكيميائي للمواد. وستتميز هذه النظرية بدقة القوانين الرياضية وستسمح بالتنبؤ بخواص المركبات العضوية.
وبعد بضع سنوات، خلال رحلته الثانية إلى الخارج، قدم بتلروف النظرية التي ابتكرها للمناقشة، وقدم تقريرًا في المؤتمر السادس والثلاثين لعلماء الطبيعة والأطباء الألمان في شباير. انعقد المؤتمر في سبتمبر 1861. وقدم عرضا إلى القسم الكيميائي. كان للموضوع عنوان أكثر من متواضع - "شيء عن التركيب الكيميائي للأجسام". في التقرير، عبر بتليروف عن الأحكام الرئيسية لنظريته حول بنية المركبات العضوية. أعمال أ.م. بتليروف
أعمال أ.م. بتليروف

مكتب أ.م. بتليروف
أتاحت نظرية التركيب الكيميائي تفسير العديد من الحقائق التي تراكمت في الكيمياء العضوية في بداية النصف الثاني من القرن التاسع عشر، وأثبتت أنه بمساعدة الطرق الكيميائية (التخليق والتحلل وغيرها من التفاعلات) كان من الممكن لتحديد ترتيب ارتباط الذرات في الجزيئات (وبالتالي أثبت إمكانية معرفة تركيب المواد)؛
لقد أدخلت شيئًا جديدًا في العلوم الذرية الجزيئية (ترتيب الذرات في الجزيئات، والتأثير المتبادل للذرات، واعتماد الخصائص على بنية جزيئات المادة). واعتبرت النظرية جزيئات المادة بمثابة نظام منظم يتمتع بديناميكيات الذرات المتفاعلة. وفي هذا الصدد، تلقى العلوم الذرية الجزيئية مزيدا من التطوير، والتي كانت ذات أهمية كبيرة لعلم الكيمياء؛
جعل من الممكن التنبؤ بخصائص المركبات العضوية بناءً على البنية، وتوليف مواد جديدة، والالتزام بالخطة؛
سمح لنا بشرح تنوع المركبات العضوية؛
لقد أعطى دفعة قوية لتخليق المركبات العضوية وتطوير صناعة التخليق العضوي (تخليق الكحوليات والإثيرات والأصباغ والمواد الطبية وما إلى ذلك).
بعد أن طور النظرية وأكد صحتها من خلال تركيب مركبات جديدة أ.م. لم يعتبر بتلروف النظرية مطلقة وغير قابلة للتغيير. لقد جادل بأنها يجب أن تتطور، وتوقع أن هذا التطور سوف يستمر من خلال حل التناقضات بين المعرفة النظرية والحقائق الجديدة الناشئة.
نظرية التركيب الكيميائي كما تنبأ بها أ.م. بتلروف، لم يبقى دون تغيير. استمر تطويرها بشكل رئيسي في اتجاهين مترابطين.
تم توقع أولهم من قبل أ.م.بتليروف نفسه
كان يعتقد أن العلم في المستقبل سيكون قادرًا على تحديد ليس فقط ترتيب ارتباط الذرات في الجزيء، ولكن أيضًا ترتيبها المكاني. دخلت دراسة التركيب المكاني للجزيئات، والتي تسمى الكيمياء المجسمة ("ستيريو" اليونانية - المكانية)، العلم في الثمانينيات من القرن الماضي. لقد جعل من الممكن شرح والتنبؤ بالحقائق الجديدة التي لا تتناسب مع إطار المفاهيم النظرية السابقة.
ويرتبط الاتجاه الثاني بالتطبيق في الكيمياء العضوية لعقيدة التركيب الإلكتروني للذرات، التي تم تطويرها في فيزياء القرن العشرين. وقد مكّن هذا المذهب من فهم طبيعة الرابطة الكيميائية للذرات، وتوضيح جوهر تأثيرها المتبادل، وشرح سبب ظهور بعض الخواص الكيميائية بواسطة المادة.
الصيغ الهيكلية، مفصلة ومختصرة
أسباب تنوع المركبات العضوية 
تشكل ذرات الكربون روابط مفردة (بسيطة)، وثنائية، وثلاثية:![]()

هناك سلسلة متماثلة:

الايزومرات:

الصفحة \* تنسيق الدمج 1
بالإضافة إلى أعمال أخرى قد تهمك |
|||
| 5908. | تنظيم النظام الدائري | 33.67 كيلو بايت | |
| اعتمادا على سرعة تطوير العمليات التكيفية، يتم تقسيم جميع آليات تنظيم الدورة الدموية إلى 3 مجموعات: قصيرة المدى (العصبية والخلطية)؛ وسيطة في الوقت المناسب؛ التمثيل الطويل... | |||
| 5909. | رعاية الكنيسة الأرثوذكسية الروسية للمسنين | 160.47 كيلو بايت | |
| تكمن أهمية المشكلة قيد الدراسة في عدم وجود نهج منهجي، وكذلك في القضية غير المتطورة المتمثلة في رعاية الكنيسة الأرثوذكسية الروسية لكبار السن. لم يتم اختيار مصطلح الرعاية عن طريق الصدفة، فهو يشمل... | |||
| 5910. | سلامة الحياة. دورة المحاضرات | 277 كيلو بايت | |
| الوحدة البديلة 1. الأسس المنهجية لسلامة الحياة 1.1. فهم جوهر سلامة الحياة 1.2. فهم المخاوف 1.3. تصنيف الاهتمامات فهم جوهر سلامة الحياة أنظر إلى سلامة الحياة... | |||
| 5911. | أساسيات علم أصول التدريس في المدرسة الثانوية. محاضرات | 1.06 ميجابايت | |
| الموضوع والأهداف والفئات الرئيسية وطرق التدريس في المدرسة الثانوية. أساسيات التدريس في المدرسة الثانوية. مبادئ وأساليب بدء الرهن العقاري الأولي الرئيسي. أشكال تنظيم التعليم في المدرسة المحلية. | |||
| 5912. | أساسيات الدراسات المتحفية. دورة المحاضرات | 335 كيلو بايت | |
| المحاضرة الأولى جوهر وأهمية العمل المتحفي والمتحفي مفهوم علم المتاحف كعلم المتحف كظاهرة اجتماعية ثقافية المتحف كمؤسسة ثقافية تصنيف المتاحف مفهوم علم المتاحف كعلم علم المتاحف... | |||
| 5913. | التقنيات في أنشطة التصنيع. ملاحظات المحاضرة | 3.02 ميجابايت | |
| التصميم كمستودع للإنتاج اليومي والنشاط البشري محاضرة المبادئ الأساسية للتصميم للنشاط البشري. العلامات الأساسية لنشاط المشروع. أنواع المشاريع. المفاهيم الأساسية: المشروع، التصميم... | |||
| 5914. | أساسيات الديناميكا الحرارية. دورة المحاضرات | 3.72 ميجابايت | |
| المفاهيم والقوانين الأساسية للديناميكا الحرارية الهندسة الحرارية هي العلم الذي يشمل عمليات الاحتفاظ بالحرارة واستعادتها في النباتات المختلفة، بالإضافة إلى الآلات والأجهزة التي تستخدم لهذه الأغراض. الديناميكا الحرارية التقنية -... | |||
| 5915. | سلامة الحياة وأمنها. محاضرات | 497.94 كيلو بايت | |
| الموضوع - الكمائن القانونية والتنظيمية للأمن الغذائي. الإطار التشريعي والتنظيمي لأوكرانيا للأمن الغذائي. المبادئ الأساسية لسياسة الحكومة الأوكرانية سارية المفعول. الإجراءات التنظيمية والقانونية لأوكرانيا بشأن حماية الغذاء. اجتماعي... | |||
| 5916. | الاقتصاد الوطني. دورة المحاضرات | 586.5 كيلو بايت | |
| الاقتصاد الوطني: الاقتصاد الوطني السري والخاص كنظام اجتماعي واقتصادي للمنطقة. الأهداف الرئيسية للاقتصاد الوطني. العوامل المؤثرة في أداء الاقتصاد الوطني. الاقتصاد الوطني كاقتصاد اجتماعي.. | |||
بحلول النصف الأول من القرن التاسع عشر، تراكمت كمية هائلة من المواد الواقعية في الكيمياء العضوية، والتي أعاقت دراستها الإضافية بسبب عدم وجود أي أساس منهجي. وبدءًا من عشرينيات القرن التاسع عشر، بدأت تظهر نظريات متتالية تدعي أنها وصف عام لبنية المركبات العضوية. إحداها كانت نظرية الأنواع، التي طورها العالم الفرنسي سي. جيرارد في الستينيات. ووفقاً لهذه النظرية فقد اعتبرت جميع المركبات العضوية مشتقات من أبسط المواد غير العضوية مأخوذة على أنها أنواع. جيرارد
قبل وقت قصير من ظهور نظرية الهيكل، قام الكيميائي الألماني ف. طور كيكولي (1857) نظرية التكافؤ فيما يتعلق بالمركبات العضوية، والتي أسست حقائق مثل رباعي التكافؤ لذرة الكربون وقدرتها على تكوين سلاسل الكربون بسبب الاتحاد مع ذرات الكربون. م. بتلروفا إف. كيكولي

قدمت التطورات النظرية في فترة ما قبل بتلر مساهمة معينة في معرفة بنية المركبات العضوية. لكن لم تكن أي من النظريات المبكرة عالمية. وفقط أ.م. تمكن بتليروف من إنشاء مثل هذه النظرية المنطقية الكاملة للبنية، والتي تعمل حتى يومنا هذا كأساس علمي للكيمياء العضوية. نظرية هيكل أ.م. يعتمد بتليروف على مقاربة مادية للجزيء الحقيقي وينطلق من إمكانية معرفة بنيته تجريبيًا. أكون. يعلق بتليروف أهمية أساسية على التفاعلات الكيميائية عند تحديد بنية المواد. نظرية هيكل أ.م. لم تشرح بتلروفا الحقائق المعروفة بالفعل فحسب، بل تكمن أهميتها العلمية في التنبؤ بوجود مركبات عضوية جديدة. بتليروف أ.م. بتلروفا إيه إم. بتليروف أ.م. بتليروف


الأيزومرات هي مواد لها نفس الصيغة الجزيئية، ولكن لها تركيب كيميائي مختلف، وبالتالي لها خصائص مختلفة. تلقت الأيزومرية تفسيرًا حقيقيًا فقط في النصف الثاني من القرن التاسع عشر على أساس نظرية التركيب الكيميائي التي كتبها أ.م. بتلروف (الإيزومرية الهيكلية) والتعاليم الكيميائية المجسمة لـ Ya. Van't Hoff (الإيزومرية المكانية). جي فانت هوف

اسم الصيغة عدد الأيزومرات CH 4 ميثان 1 C4H6C4H6 إيثان 1 C3H8C3H8 بروبان 1 C 4 H 10 بوتان 2 C 5 H 12 بنتان 3 C 6 H 14 هكسان 5 C 7 H 16 هيبتان 9 C 8 H 18 أوكتان 18 C 9 H 20 نونان 35 C 10 H 22 ديكان 75 C 11 H 2 4 undecane159 C 12 H 26 Dodecane355 C 13 H 28 TrideCane802 C 14 H 30 Tetradecane1 858 C 15 H 32 Pentadecane4 347 C 20 H 42 Eicosane C 25 H 52 Pentacosane C 30 H 62 Triacontane C 40 H 82 Tetracontane

الأيزومرات الهيكلية هي تلك التي تتوافق مع الصيغ الهيكلية المختلفة للمركبات العضوية (مع اختلاف رتب الذرات). الأيزومرات المكانية لها بدائل متطابقة على كل ذرة كربون وتختلف فقط في موقعها النسبي في الفضاء.

الايزومرات المكانية (الايزومرات المجسمة). يمكن تقسيم الأيزومرات الفراغية إلى نوعين: الأيزومرات الهندسية والأيزومرات الضوئية. الأيزومرية الهندسية هي سمة من سمات المركبات التي تحتوي على رابطة مزدوجة أو حلقة. في مثل هذه الجزيئات، يكون من الممكن في كثير من الأحيان رسم مستوى تقليدي بحيث تكون البدائل الموجودة على ذرات الكربون المختلفة على نفس الجانب (cis-) أو على الجانبين المتقابلين (trans-) لهذا المستوى. إذا كان التغيير في اتجاه هذه البدائل بالنسبة للطائرة ممكنا فقط بسبب كسر أحد الروابط الكيميائية، فإنهم يتحدثون عن وجود أيزومرات هندسية. تختلف الأيزومرات الهندسية في خواصها الفيزيائية والكيميائية.





تم اكتشاف طريقة جديدة للحصول على الأيزومرات الضوئية للجزيئات العضوية. عندما وجدت أليس نفسها في غرفتها الخاصة، ولكن "المرآة"، تفاجأت: الغرفة بدت متشابهة، لكنها لا تزال مختلفة تمامًا. تختلف الأيزومرات المرآة للجزيئات الكيميائية بنفس الطريقة: فهي تبدو متشابهة، ولكنها تتصرف بشكل مختلف. أحد المجالات الحاسمة في الكيمياء العضوية هو فصل وتركيب هذه المتغيرات المرآة. (رسم توضيحي لجون تينيل لكتاب لويس كارول "أليس من خلال المرآة")


لقد تعلم العلماء الأمريكيون كيفية الحصول على الأيزومرات الضوئية للمركبات القائمة على الألدهيدات، وأجروا أخيرًا تفاعلًا مهمًا ظل الكيميائيون يعملون عليه لسنوات عديدة. في التجربة، قاموا بدمج اثنين من المحفزات التي تعمل على مبادئ مختلفة. ونتيجة للعمل المشترك لهذه المحفزات، يتم تشكيل جزيئين عضويين نشطين، يتحدان لتكوين المادة المطلوبة. وباستخدام هذا التفاعل كمثال، تم إثبات إمكانية تصنيع فئة كاملة من المركبات العضوية ذات الأهمية البيولوجية.

من المعروف الآن ما لا يقل عن 130 تفاعل تخليق عضوي يتم من خلالها الحصول على أيزومرات كيرالية نقية أكثر أو أقل. إذا كان للمحفز نفسه خصائص مراوانية، فسيتم الحصول على منتج نشط بصريًا من ركيزة غير نشطة بصريًا. تم اشتقاق هذه القاعدة في بداية القرن العشرين ولا تزال أساسية حتى اليوم. يشبه مبدأ العمل الانتقائي للمحفز فيما يتعلق بالإيزومرات الضوئية المصافحة: من "المريح" أن يرتبط المحفز بواحد فقط من الأيزومرات اللولبية، وبالتالي يتم تحفيز تفاعل واحد فقط من التفاعلات بشكل تفضيلي. بالمناسبة، مصطلح "chiral" يأتي من اليد اليونانية.