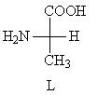
Окисляется при гликолизе. Гликолиз
1 Глик о лиз (от греч. glykys - сладкий и lysis - распад, разложение), процесс анаэробного ферментативного негидролитического расщепления углеводов (главным образом глюкозы) в животных тканях, сопровождающийся синтезом аденозинтрифосфорной кислоты (АТФ) (см. Аденозинфосфорные кислоты) заканчивающийся образованием молочной кислоты. Г. имеет большое значение для мышечных клеток, сперматозоидов, растущих (в т. ч. опухолевых) тканей, т.к. обеспечивает накопление энергии в отсутствии кислорода. Продукты, образующиеся при Г., являются субстратами последующих окислительных превращений (см. Трикарбоновых кислот цикл). Процессами, аналогичными Г., являются молочнокислое, маслянокислое, спиртовое и пр. видыброжения, протекающего в растительных, дрожжевых и бактериальных клетках. Интенсивность отдельных стадий Г. зависит от кислотности - водородного показателя - рН (оптимум рН 7-8), температуры и ионного состава среды. Последовательность реакций Г. (см. схему) хорошо изучена, идентифицированы промежуточные продукты, выделены ферменты Г. в кристаллическом или очищенном виде.
2 Углеводный обмен или метаболизм углеводов в организмах животных и человека . Метаболизм углеводов в организме человека состоит из следующих процессов:
Расщепление в пищеварительном тракте поступающих с пищей поли- и дисахаридов до моносахаридов , дальнейшее всасывание моносахаридов из кишечника в кровь .
Синтез и распад гликогена в тканях (гликогенез и гликогенолиз ), прежде всего в печени .
Гликолиз - распад глюкозы . Первоначально под этим термином обозначали только анаэробное брожение , которое завершается образованием молочной кислоты (лактата) или этанола иуглекислого газа . В настоящее время понятие «гликолиз» используется более широко для описания распада глюкозы, проходящего через образование глюкозо-6-фосфата , фруктозодифосфата и пирувата как в отсутствии, так и в присутствии кислорода . В последнем случае употребляется термин «аэробный гликолиз», в отличие от «анаэробного гликолиза», завершающегося образованием молочной кислоты или лактата.
Аэробный путь прямого окисления глюкозы или, как его называют, пентозофосфатный путь (пентозный цикл).
Взаимопревращение гексоз
Аэробный метаболизм пирувата. Этот процесс выходит за рамки углеводного обмена, однако может рассматриваться как завершающая его стадия: окисление продукта гликолиза - пирувата.
Глюконеогенез - образование углеводов из неуглеводных продуктов (пирувата , лактата , глицерина , аминокислот , липидов , белков и т. д.).
3Ци ́ кл трикарбо ́ новых кисло ́ т (цикл Кре ́ бса , цитра ́ тный цикл , цикл лимонной кислоты ) - центральная часть общего путикатаболизма , циклический биохимический аэробный процесс, в ходе которого происходит превращение двух- и трёхуглеродных соединений, образующихся как промежуточные продукты в живых организмах при распаде углеводов, жиров и белков, до CO 2 . При этом освобождённый водород направляется в цепь тканевого дыхания, где в дальнейшем окисляется до воды, принимая непосредственное участие в синтезе универсального источника энергии - АТФ .
Цикл Кребса - это ключевой этап дыхания всех клеток , использующих кислород, центр пересечения множества метаболических путей в организме. Кроме значительной энергетической роли циклу отводится также и существенная пластическая функция, то есть это важный источник молекул-предшественников, из которых в ходе других биохимических превращений синтезируются такие важные для жизнедеятельности клетки соединения как аминокислоты, углеводы, жирные кислоты и др.
Цикл превращения лимонной кислоты в живых клетках был открыт и изучен немецким биохимиком Хансом Кребсом , за эту работу он (совместно с Ф. Липманом ) был удостоен Нобелевской премии (1953 год ).
У эукариот все реакции цикла Кребса протекают внутри митохондрий , причём катализирующие их ферменты , кроме одного, находятся в свободном состоянии в митохондриальном матриксе, исключение составляет сукцинатдегидрогеназа , которая локализуется на внутренней митохондриальной мембране, встраиваясь в липидный бислой. У прокариот реакции цикла протекают в цитоплазме.
4 Пентозофосфатный путь окисления углеводов
Открытие пути прямого окисления углеводов , или, как его называют, пентозофосфатного цикла , принадлежит О. Варбургу, Ф. Липману, Ф. Ди-кенсу и В.А. Энгельгарду. Расхождение путей окисления углеводов – классического (цикл трикарбоновых кислот , или цикл Кребса ) и пентозофос-фатного – начинается со стадии образования гексозомонофосфата. Если глюкозо-6-фосфат изомеризуется во фруктозо-6-фосфат, который фосфо-рилируется второй раз и превращается во фруктозо-1,6-бисфосфат, то в этом случае дальнейший распад углеводов происходит по обычному гликолитическому пути с образованием пировиноградной кислоты , которая, окисляясь до ацетил-КоА, затем «сгорает» в цикле Кребса .
Если второго фосфорилирования гексозо-6-монофосфата не происходит, то фосфорилированная глюкоза может подвергаться прямому окислению до фосфопентоз. В норме доля пентозофосфатного пути в количественном превращении глюкозы обычно невелика, варьирует у разных организмов и зависит от типа ткани и ее функционального состояния.
У млекопитающих активность пентозофосфатного цикла относительно высока в печени , надпочечниках, эмбриональнойткани и молочной железе в период лактации. Значение этого пути в обмене веществ велико. Он поставляет восстановленный НАДФН, необходимый для биосинтеза жирных кислот , холестерина и т.д. За счет пентозофосфатного цикла примерно на 50% покрывается потребность организма в НАДФН.
Другая функция пентозофосфатного цикла заключается в том, что он поставляет пентозофосфаты для синтезануклеиновых кислот и многих коферментов . При ряде патологических состояний удельный вес пенто-зофосфатного путиокисления глюкозы возрастает. Механизм реакций пентозофосфатного цикла достаточно расшифрован
Окислительное декарбоксилирование пирувата[править]
Дополнительные сведения: Пируватдегидрогеназный комплекс
Окисление пирувата до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединённых структурно в мультиферментную систему, получившую название «пируватдегидрогеназный комплекс».
На I стадии этого процесса пируват теряет свою карбоксильную группу в результате взаимодействия с тиаминпирофосфатом (ТПФ) в составе активного центра фермента пируватдегидрогеназы (E 1). На II стадии оксиэтильная группа комплекса E 1 -ТПФ-СНОН-СН 3 окисляется с образованием ацетильной группы, которая одновременно переносится на амид липоевой кислоты (кофермент), связанной с ферментом дигидролипоилацетилтрансферазой (Е 2). Этот фермент катализирует III стадию - перенос ацетильной группы на коэнзим КоА (HS-KoA) с образованием конечного продуктаацетил-КоА , который является высокоэнергетическим (макроэргическим ) соединением.
На IV стадии регенерируется окисленная форма липоамида из восстановленного комплекса дигидролипоамид-Е 2 . При участии фермента дигидролипоилдегидрогеназы (Е 3) осуществляется перенос атомов водорода от восстановленных сульфгидрильных групп дигидролипоамида на ФАД, который выполняет роль простетической группы данного фермента и прочно с ним связан. На V стадии восстановленный ФАДН 2 дигидролипоилдегидрогеназы передает водород на кофермент НАД с образованием НАДН + Н + .
Процесс окислительного декарбоксилирования пирувата происходит в матриксе митохондрий . В нём принимают участие (в составе сложного мультиферментного комплекса ) 3 фермента (пируватдегидрогеназа, дигидролипоилацетилтрансфераза, дигидролипоилдегидрогеназа) и 5 коферментов (ТПФ, амид липоевой кислоты, коэнзим А , ФАД и НАД), из которых три относительно прочно связаны с ферментами (ТПФ-E 1 , липоамид-Е 2 и ФАД-Е 3), а два - легко диссоциируют (HS-KoA и НАД).
Все эти ферменты, имеющие субъединичное строение, и коферменты организованы в единый комплекс. Поэтому промежуточные продукты способны быстро взаимодействовать друг с другом. Показано, что составляющие комплекс полипептидные цепи субъединиц дигидролипоил-ацетилтрансферазы составляют как бы ядро комплекса, вокруг которого расположены пируватдегидрогеназа и дигидролипоилдегидрогеназа. Принято считать, что нативный ферментный комплекс образуется путем самосборки.
Суммарную реакцию, катализируемую пируватдегидрогеназным комплексом, можно представить следующим образом:
Пируват + НАД + + HS-KoA = Ацетил-КоА + НАДН + Н + + СO 2 .
Реакция сопровождается значительным уменьшением стандартной свободной энергии и практически необратима.
Образовавшийся в процессе окислительного декарбоксилирования ацетил-КоА подвергается дальнейшему окислению с образованием СО 2 и Н 2 О. Полное окисление ацетил-КоА происходит в цикле трикарбоновых кислот (цикл Кребса ). Этот процесс, так же как окислительное декарбоксилирование пирувата, происходит в митохондриях клеток.
Гликолиз - специфический путь катаболизма глюкозы, в результате которого происходит расщепление глюкозы с образованием двух молекул пирувата - аэробный гликолиз или две молекулы лактата - анаэробный гликолиз .
При аэробных условиях пируват проникает в митохондрии, где полностью окисляется до СО2 и Н2О. Если содержание кислорода недостаточно, как это может иметь место в активно сокращающейся мышце,пируват превращается в лактат.Итак, гликолиз – не только главный путь утилизации глюкозы в клетках, но и уникальный путь, поскольку он может использовать кислород, если последний доступен (аэробные условия), но может протекать и в отсутствие кислорода (анаэробные условия).
Анаэробный гликолиз – сложный ферментативный процесс распада глюкозы, протекающий в тканях человека и животных без потребления кислорода. Конечным продуктом гликолиза является молочная кислота. В процессе гликолиза образуется АТФ. Суммарное уравнение гликолиза можно
представить следующим образом:
С6Н12О6 + 2АДФ + 2ФН –> 2СН3СН(ОН)СООН + 2АТФ + 2Н2О.
Глюкоза Молочная кислота
В анаэробных условиях гликолиз – единственный процесс в животном организме, поставляющий энергию. Именно благодаря гликолизу организм человека и животных определенный период может осуществлять ряд физиологических функций в условиях недостаточности кислорода. В тех случаях, когда гликолиз протекает в присутствии кислорода, говорят об аэробном гликолизе.
В аэробном и анаэробном гликолизе можно выделить два этапа.
А. Превращение глюкозы в две молекулы глицеральдегид-3-фосфата. Эта серия реакции протекает с потреблением АТФ.
Б. Превращение глицеральдегидфосфата в пируват или лактат. Эти реакции связаны с образованием АТФ. На этом этапе происходит реакция дегидрирования глицеральдегид-3- фосфата и образование NADH+H+.
3. Химизм и характеристика I этапа гликолиза.
Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой:
Глюкоза Гексокиназа Глюкозо-6-фосфат
Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.
Наиболее важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, т.е. последний служит одновременно и продуктом реакции, и аллостерическим ингибитором.
Второй реакцией гликолиза является превращение глюкозо-6-фос-фата под действием фермента глюкозо-6-фосфат-изомеразы во фруктозо-6-фосфат:

Глюкозо-6-фосфат Глюкозо-6-фосфат- изомераза Фруктозо-6-фосфат
Эта реакция протекает легко в обоих направлениях, и для нее нетребуется каких-либо кофакторов.
Третья реакция катализируется ферментом фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ:

Фруктозо-6-фосфат 6-Фосфофруктокиназа Фруктозо-1,6-бисфосфат
Данная реакция аналогично гексокиназной практически необратима, протекает в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза. Фактически эта реакция определяет скорость
гликолиза в целом.
Четвертую реакцию гликолиза катализирует фермент альдолаза.
Под влиянием этого фермента фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:

Фруктозо-1,6-бисфосфат Альдолаза Диоксиацетонфосфат Глицеральдегид-3-фосфат
Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (дигидроксиацетонфосфата и глицеральдегид-3-фосфата)
Пятая реакция – это реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой:

Диоксиацетон- фосфат Триозофосфатизо-мераза Глицеральдегид-3-фосфат
Равновесие данной изомеразной реакции сдвинуто в сторону дигидроксиацетонфосфата: 95% дигидроксиацетонфосфата и около 5% глицеральдегид-3-фосфата. В последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов,а именно глицеральдегид-3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы дигидроксиацетонфосфат превращается в глицеральдегид-3-фосфат.
Образованием глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза.
Гликолиз (от греч. glycys – сладкий, lysis - разрушение) – универсальный и основной процесс катаболизма углеводов для большинства организмов. Гликолиз – процесс анаэробный, однако он может протекать как в отсутствие, так и в присутствии кислорода. Он является ключевым метаболитическим путем, генерирующим энергию в форме АТФ в клетках, где отсутствует фотосинтез.
Исследования химизма гликолиза показали, то начальные этапы процессов брожения и дыхания имеют общий путь. Это открытие было уникальным, потому что оно вскрывало существование внутреннего единства в живой материи. При дыхании у аэробных организмов гликолиз предшествует циклу трикарбоновых кислот и цепи переноса электронов. Пируват проникает в митохондрии, где он полностью окисляется до СО2, в результате чего с высокой эффективностью из гексозы извлекается свободная энергия. При брожении, в анаэробных условиях, пируват превращается в продукты брожения. У подавляющей части клеток ферменты, катализирующие гликолитические реакции, присутствуют в растворимой форме в цитозоле, т.е. в гомогенной водной фазе цитоплазмы. В отличие от них ферменты, катализирующие те этапы окисления углеводов, которые требуют присутствия кислорода, локализуются в митохондриальных мембранах.
Расщепление шестиуглеродной молекулы глюкозы на две трехуглеродные молекулы пирувата совершается при участии десяти ферментов. Все они были выделены в чистом виде из разных видов организмов и тщательно изучены.
Гликолиз осуществляется во всех живых клетках организмов. В процессе гликолиза происходит преобразование молекулы гексозы до двух молекул пировиноградной кислоты: С 6 Н 12 O 6 -> 2С 3 Н 4 O 2 + 2Н 2 . Этот окислительный процесс может протекать в анаэробных условиях (в отсутствие кислорода) и идет через ряд этапов. Прежде всего, для того чтобы подвергнуться дыхательному распаду, глюкоза должна быть активирована. Активация глюкозы происходит путем фосфорилирования шестого углеродного атома за счет взаимодействия с АТФ:
глюкоза + АТФ → глюкозо-6-фосфат + АДФ
Реакция идет в присутствии ионов магния и фермента гексокиназа. Затем глюкозо-6-фосфат изомеризуется до фруктозо-6-фосфата. Процесс катализируется ферментом фосфоглюкоизомеразой:
глюкозо-6-фосфат → фруктозо-6-фосфат
фруктозо-6-фосфат + АТФ → фруктозо-1,6-дифосфат + АДФ
Дальнейшие реакции, составляющие процесс гликолиза, складываются следующим образом: фруктозо-1,6-дифосфат расщепляется с образованием двух триоз, реакция катализируется ферментом альдолазой, которая состоит из четырех субъединиц и содержит свободные SH-группы. Молекула фосфодиоксиацетона при участии фермента триозофосфатизомеразы превращается также в 3-фосфоглицериновый альдегид (ФГА). Дальнейшим превращениям подвергается именно ФГА, окисляясь до 1,3-дифосфоглицериновой кислоты (ДФГК). Это важнейший этап гликолиза. Процесс идет с участием неорганического фосфата (Н 3 РO 4) и фермента глицеральдегид-3-фосфатдегидро-геназы. Молекула этого фермента состоит из четырех идентичных субъединиц. Каждая субъединица представляет одиночную полипептидную цепь приблизительно из 220 аминокислотных остатков. Фермент содержит SH-группы и кофермент НАД, который взаимосвязан с ферментом на всем протяжении процесса. Сущность процесса заключается в окислении альдегидной группы ФГА в карбоксильную ДФГК. Окисление идет с выделением энергии. За счет энергии окисления при участии неорганического фосфата (Н 3 РO 4) в молекуле ДФГК образуется макроэргическая фосфатная связь. Одновременно происходит восстановление кофермента НАД.
Поскольку при распаде одной молекулы глюкозы образуются две молекулы ФГА, то все реакции повторяются дважды. Таким образом, суммарное уравнение гликолиза. В результате процесса гликолиза образуются четыре молекулы АТФ, однако две из них покрывают расход на первоначальное активирование субстрата. Следовательно, накапливаются две молекулы АТФ. Образование АТФ в процессе следующее:
C6H12O6 + 2АТФ + 2НАД + 2Фн + 4АДФ → 2ПВК 2НАДН + 2Н + + 4АТФ + 2АДФ
Реакция гликолиза носит название субстратного фосфорилирования, поскольку макроэргические связи возникают на молекуле окисляемого субстрата. Если считать, что при распаде АТФ из АДФ и Фн выделяется 30,6 кДж, то за период гликолиза накапливается в макроэргических фосфатных связях всего 61,2 кДж. Прямые определения показывают, что распад молекулы глюкозы до пировиноградной кислоты сопровождается выделением 586,6 кДж. Следовательно, энергетическая эффективность гликолиза невелика. Кроме того, образуются 2 молекулы НАДН, которые вступают в дыхательную цепь, что приводит к дополнительному образованию АТФ. Образовавшиеся две молекулы пировиноградной кислоты участвуют в аэробной фазе дыхания.
Регуляция гликолиза
Гликолиз выполняет две функции:
1)
генерирует АТФ за счет расщепления
гексозы
2)
поставляет строительные блоки для реакций
синтеза.
Его регуляция и направлена на удовлетворение этих двух потребностей клетки. Реакции, катализируемые гексокиназой, фосфофруктокиназой и пируваткиназой, практически необратимы; они выполняют не только каталитическую, но и регуляторную функции.
Особая роль в выполнении регуляторной функции отводится фосфофруктокиназе (катализирует превращение фруктозо-6-фосфата в фруктозо-1,6-дифосфат, данная реакция является наиболее медленно текущей и определяет скорость всего процесса). Активность фосфофруктокиназы аллостерически контролируется рядом важных метаболитов, а именно:
1)
фосфорилированными промежуточными
продуктами, такими как глицеральдегид-3-фосфат, 2-фосфоглицерат и
фосфоенолпируват;
2)
адениннуклеотидом и ортофосфатом.
Фосфофруктокиназа ингибируется высокими концентрациями АТФ, снижающими ее
сродство к фруктозо-6-фосфату.
Активность фермента возрастает при снижении отношения АТФ/АМФ. Иначе говоря, гликолиз стимулируется в условиях низкого уровня энергии в клетке. На активность фосфофруктокиназы влияют также избыток или недостаток строительных блоков. Так, она ингибируется цитратом – ромежуточным продуктоам на начальных стадиях цикла трикарбоновых кислот. Избыток цитрата означает, что соединения, играющие в биосинтезе роль предшественников, присутствуют в больших количествах и, следовательно, необходимо снижение интенсивности гликолиза. Таким образом, когда клетка нуждается в энергии и строительных блоках, о чем свидетельствует низкое значение отношения АТФ/АМФ и низкое содержание цитрата, фосфофруктокиназа наиболее активна. При избытке энергии и строительных углеродных фрагментов активность фермента резко снижается.
Катализирующая неравновесную реакцию пируваткиназа (перенос фосфатной группы от фосфоенолпирувата на АДФ) ингибируется АТФ и цитратом и активируется своим субстратом и АДФ.
Повышение уровня АТФ, глюкозо-6-фосфата, как и цитрата, приводит к ингибированию гексокиназы (катализирует реакцию фосфорилирование глюкозы с образованием глюкозо-6-фосфат).
Гликолиз (от греч. glycus - сладкий и lysis - растворение, распад) - сложный ферментативный процесс превращения глюкозы, протекающий в тканях человека и животных без потребления кислорода. Конечным продуктом гликолиза является молочная кислота. В процессе гликолиза образуется также АТФ. Суммарное уравнение гликолиза можно изобразить следующим образом:
В анаэробных условиях гликолиз - единственный процесс в животном организме, поставляющий энергию. Именно благодаря процессу гликолиза организм человека и животных определенный период времени может осуществлять ряд физиологических функций в условиях недостаточности кислорода. В тех случаях, когда гликолиз протекает в присутствии кислорода, говорят об аэробном гликолизе. (В аэробных условиях гликолиз можно рассматривать как первую стадию окисления глюкозы до конечных продуктов этого процесса - углекислоты и воды. )
Впервые термин «гликолиз» применил Лепин в 1890 г. для обозначения процесса убыли глюкозы в крови, изъятой из кровеносной системы, т. е. in vitro.
У ряда микроорганизмов процессами, аналогичными гликолизу, являются различные виды брожения .
Последовательность реакций гликолиза, так же как и их промежуточные продукты, хорошо изучена. Процесс гликолиза катализируется одиннадцатью ферментами, большинство из которых выделено в гомогенном, кристаллическом или высокоочищенном виде и свойства которых достаточно изучены. Заметим, что гликолиз протекает в гиалоплазме клетки. В табл. 27 приведены данные относительно скорости анаэробного гликолиза в различных тканях крысы.
Первой ферментативной реакцией гликолиза является фосфорилирование, т. е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой:
Образование глюкозо-6-фосфата в гексокиназной реакции связано с освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.
Фермент гексокиназа способен катализировать фосфорилирование не только D-глюкозы, но и других гексоз, в частности D-фруктозы, D-маннозы и др.
Второй реакцией гликолиза является превращение глюкозо-6-фосфата под действием фермента гексозофосфатизомеразы во фруктозо-6-фосфат:

Эта реакция протекает легко в обоих направлениях и не нуждается в присутствии каких-либо кофакторов.
В третьей реакции образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ. Реакция катализируется ферментом фосфофруктокиназой:

Данная реакция аналогично гексокиназной практически необратима, протекает она в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза. Фактически эта реакция определяет скорость гликолиза в целом.
Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируется АДФ и АМФ. (Активность фосфофруктокиназы ингибируется также цитратом. Показано, что при диабете, голодании и некоторых других состояниях, когда интенсивно используются жиры как источник энергии, в клетках тканей содержание цитрата может возрастать в несколько раз. В этих условиях происходит резкое торможение активности фосфофруктокиназы цитратом. ). При значительных величинах отношения АТФ/АДФ (что достигается в процессе окислительного фосфорилирования) активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза.
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо-1,6-дифосфат расщепляется на две фосфотриозы:

Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. В целом же при повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (диоксиацетонфосфата и глицеральдегид-3-фосфата).
Пятая реакция - реакция изомеризации триозофосфатов. Катализируется эта реакция ферментом триозофосфатизомеразой:

Равновесие данной изомеразной реакции сдвинуто в сторону дигидроксиацетонфосфата: 95% дигидроксиацетонфосфата и около 5% глицеральдегид-3-фосфата. Однако в последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы дигидроксиацетонфосфат превращается в глицеральдегид-3-фосфат.
Образованием глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза. Вторая стадия - наиболее сложная и важная часть гликолиза. Она включает окислительно-восстановительную реакцию (гликолитическую оксидоредукцию), сопряженную с субстратным фосфорилированием, в процессе которого образуется АТФ.
В шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы (дегидрогеназой 3-фосфоглицеринового альдегида ), кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-дифосфоглицериновой кислоты и восстановленной формы НАД (НАДН 2). Эта реакция блокируется йод- или бромацетатом, протекает она в несколько этапов. Суммарно данную реакцию можно изобразить в следующем виде:

1,3-Дифосфоглицериновая кислота представляет собой высокоэнергетическое соединение. Механизм действия глицеральдегид-фосфатдегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН 2 глицеральдегид-3-фосфат связывается с молекулой фермента за счет SH-групп последнего. Образовавшаяся связь богата энергией, но она непрочна и расщепляется под влиянием неорганического фосфата. При этом образуется 1,3-дифосфоглицериновая кислота.
В седьмой реакции, которая катализируется фосфоглицераткиназой, происходит передача богатой энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с образованием АТФ и 3-фосфоглицериновой кислоты (3-фосфоглицерата):

Таким образом, благодаря действию двух ферментов (глицеральдегидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ.
В восьмой реакции происходит внутримолекулярный перенос оставшейся фосфатной группы и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту (2-фосфоглицерат).
Реакция легкообратима, протекает в присутствии ионов Mg 2+ . Кофактором фермента является также 2,3-дифосфоглицериновая кислота, аналогично тому, как в фосфоглюкомутазной реакции роль кофактора выполнялась глюкозо-1,6-дифосфатом:

В девятой реакции 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват). При этом фосфатная связь в положении 2 становится высокоэргической. Реакция катализируется ферментом енолазой:

Енолаза активируется двухвалентными катионами Mg 2+ или Мn 2+ и ингибируется фторидом.
В десятой реакции происходят разрыв высокоэргической связи и перенос фосфатного остатка от фосфоенолпировиноградной кислоты на АДФ. Катализируется эта реакция ферментом пируваткиназой:

Для действия пируваткиназы необходимы Mg 2+ или Мn 2+ , а также одновалентные катионы щелочных металлов (К + или другие). Внутри клетки реакция является практически необратимой.
В одиннадцатой реакции в результате восстановления пировиноградной кислоты образуется молочная кислота. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАДН 2+ :

В целом последовательность протекающих при гликолизе реакций может быть представлена в следующем виде (рис. 84).




Реакция восстановления пирувата завершает внутренний окислительно-восстановительный цикл гликолиза. При этом НАД здесь играет роль лишь промежуточного переносчика водорода от глицеральдегид-3-фосфата (шестая реакция) на пировиноградную кислоту (одиннадцатая реакция). Ниже схематично изображена реакция гликолитической оксидоредукции, а также указаны этапы, на которых происходит образование АТФ (рис. 85).
Биологическое значение процесса гликолиза прежде всего заключается в образовании богатых энергией фосфорных соединений. В первой стадии гликолиза затрачиваются две молекулы АТФ (гексокиназная и фосфофруктокиназная реакции). Во второй стадии образуются четыре молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции).
Таким образом, энергетическая эффективность гликолиза составляет две молекулы АТФ на одну молекулу глюкозы.
Известно, что изменение свободной энергии при расщеплении глюкозы до двух молекул молочной кислоты составляет около 210 кДж/моль:
Из этого количества энергии около 126 кДж рассеивается в виде тепла, а 84 кДж накапливаются в форме богатых энергией фосфатных связей АТФ. Концевая макроэргическая связь в молекуле АТФ соответствует примерно 33,6-42,0 кДж/моль. Таким образом, коэффициент полезного действия анаэробного гликолиза составляет около 0,4.
Величины изменения свободной энергии точно определены для отдельных реакций гликолиза в интактных эритроцитах человека. Установлено, что восемь реакций гликолиза близки к равновесию, а три реакции (гексокиназная, фосфофруктокиназная, пируваткиназная) далеки от него, поскольку они сопровождаются значительным уменьшением свободной энергии, т. е. практически являются необратимыми.
Как уже отмечалось, основной лимитирующей скорость гликолиза реакцией является реакция, катализируемая фосфофруктокиназой. Вторым этапом, лимитирующим скорость и регулирующим гликолиз, служит гексокиназная реакция. Кроме того, контроль гликолиза осуществляется также лактатдегидрогеназой (ЛДГ) и ее изоферментами. В тканях с аэробным метаболизмом (ткани сердца, почек и др.) преобладают изоферменты ЛДГ 1 и ЛДГ 2 . Эти изоферменты ингибируются даже небольшими концентрациями пирувата, что препятствует образованию молочной кислоты и способствует более полному окислению пирувата (точнее, ацетил-КоА) в цикле трикарбоновых кислот.
В тканях человека, в значительной степени зависящих от энергии, образующейся в процессе гликолиза (например, скелетные мышцы), главными изоферментами являются ЛДГ 5 и ЛДГ 4 . Активность ЛДГ 5 максимальна при тех концентрациях пирувата, которые ингибируют ЛДГ 1 . Преобладание изоферментов ЛДГ 4 и ЛДГ 5 обусловливает интенсивный анаэробный гликолиз с быстрым превращением пирувата в молочную кислоту.
Включение других углеводов в процесс гликолиза
Эффект Пастера
Снижение скорости потребления глюкозы и прекращение накопления лактата в присутствии кислорода носит название эффекта Пастера. Впервые это явление наблюдал Л. Пастер во время своих широко известных исследований, касающихся роли брожения в производстве вина. В дальнейшем было показано, что эффект Пастера наблюдается также в животных и растительных тканях, где O 2 тормозит анаэробный гликолиз. Значение эффекта Пастера, т. е. перехода в присутствии O 2 от анаэробного гликолиза или брожения к дыханию, состоит в переключении клетки на более экономный путь получения энергии. В результате скорость потребления субстрата, например глюкозы, в присутствии O 2 снижается. Молекулярный механизм эффекта Пастера заключается, по-видимому, в конкуренции между системами дыхания и гликолиза (брожения) за аденозиндифосфат (АДФ), используемый для образования аденозинтрифосфата (АТФ). Как мы уже знаем, в аэробных условиях значительно эффективнее, чем в анаэробных, происходят удаление Ф н и АДФ, генерация АТФ, а также удаление восстановленного НАД (НАДН 2). Иными словами, уменьшение в присутствии кислорода количества Ф н и АДФ и соответствующее увеличение количества АТФ ведут к подавлению анаэробного гликолиза.
Гликогенолиз
Процесс анаэробного распада гликогена получил название гликогенолиза. Вовлечение D-глюкозных единиц гликогена в процесс гликолиза происходит при участии трех ферментов - гликогенфосфорилазы,(или фосфорилазы «а»), амило-1,6-глюкозидазы и фосфоглюкомутазы.
Образовавшийся в ходе фосфоглюкомутазной реакции глюкозо-6-фосфат может включаться в процесс гликолиза. После образования глюкозо-6-фосфата дальнейшие пути гликолиза и гликогенолиза полностью совпадают:

В процессе гликогенолиза в виде макроэргических соединений накапливаются не две, а три молекулы АТФ (не тратится АТФ на образование глюкозо-6-фосфата). На первый взгляд, энергетически эффективность гликогенолиза может считаться несколько более высокой по сравнению с процессом гликолиза. Однако надо иметь в виду, что в процессе синтеза гликогена в тканях расходуется АТФ, поэтому в энергетическом плане гликогенолиз и гликолиз практически равноценны.
ГЛИКОЛИЗ (греч, glykys сладкий + lysis разрушение, распад) - сложный ферментативный процесс превращения глюкозы, протекающий в тканях животных и человека без потребления кислорода и приводящий к образованию молочной кислоты и АТФ.
C 6 H 12 O 6 + 2АДФ + 2Ф неорг. -> 2CH 3 CHOHCOOH + 2АТФ + 2H 2 O.
Именно благодаря Г. организм человека и животных может осуществлять ряд физиол, функций в условиях недостаточности кислорода.
В тех случаях, когда Г. протекает на воздухе или в атмосфере кислорода, говорят об аэробном Г. В анаэробных условиях Г.- единственный процесс в животном организме, поставляющий энергию. В аэробных условиях Г. является первой стадией окислительного превращения глюкозы и других углеводов до конечных продуктов этого процесса - углекислоты и воды. Процессами, аналогичными Г., у растений и микроорганизмов являются различные виды брожения (см.). Впервые термин «гликолиз» был предложен Лепином (Lepine) в 1890 г.
Последовательность реакций в процессе Г., также как и их промежуточные продукты, хорошо изучены. Реакции Г. катализируются одиннадцатью ферментами, большинство из которых выделены в гомогенном, кристаллическом или высоко очищенном виде и свойства которых тщательно изучены.
Наиболее интенсивен Г. в скелетных мышцах, в печени, сердце, мозге и других органах. В клетке Г. протекает в гиалоплазме.
Первой ферментативной реакцией (см. схему), открывающей цепь реакций Г., является реакция взаимодействия D-глюкозы с АТФ (2), приводящая к образованию глюкозо-6-фосфата и обеспечивающая возможность дальнейшего превращения глюкозы в процессе Г. Реакция катализируется гексокиназой (см.). Эта реакция сопровождается выделением значительного количества энергии и поэтому практически необратима. В скелетных мышцах и печени глюкозо-6-фосфат в больших количествах образуется также при катаболизме гликогена, т. е. при гликогенолизе.
Второй реакцией Г. (схема, реакция 2) является изомеризация глюкозо-6-фосфата во фруктозо-6-фосфат, катализируемая глюкозофосфатизомеразой, не нуждающейся в присутствии каких-либо кофакторов. Образующая смесь двух гексозомонофосфатов, состоящая приблизительно на 80% из глюкозо-6-фос-фата и на 20% из фруктозо-6-фосфата с примесью нек-рого количества других фосфомоноэфиров, носит название эфира Эмбдена. Такая же смесь, но состоящая из глюкозо-6-фосфата почти наполовину, называется эфиром Робисона.
Фруктозо-6-фосфат, далее в фосфофруктокиназной реакции (схема, реакция 3) за счет АТФ фосфорилируется во фруктозо-1,6-дифосфат. Фруктозодифосфат является специфическим субстратом именно для Г., тогда как предыдущие реакции характерны не только для Г., но и для окислительного распада углеводов. Фосфофруктокиназа - регуляторный фермент, имеющий на молекуле 7, а по данным некоторых авторов, 12 центров связывания субстратов, кофакторов и ингибиторов. Фермент активируется ионами двухвалентных металлов, неорганическим фосфатом, АДФ, АМФ, циклическим 3",5"-АМФ. Активность фермента также повышается в присутствии фруктозо-6-фосфата и фруктозо-1,6-дифосфата. Ингибируют фермент АТФ и цитрат.
Реакция, катализируемая фосфофруктокиназой, является наиболее медленно текущей реакцией Г., определяющей скорость всего процесса. Главными факторами в клетке, контролирующими фосфофруктокиназу, являются относительные концентрации АТФ и АДФ. Когда величина отношения АТФ/АДФ + Ф неорг. значительна, что достигается в процессе окислительного фосфорилирования (см.), происходит угнетение фосфофруктокиназы, и Г. замедляется. При снижении величины отношения АТФ/АДФ + Ф неорг. интенсивность Г. повышается. В неработающей мышце активность фосфофруктокиназы низка, что объясняется высокой концентрацией АТФ (см. Аденозинтрифосфорная кислота). В процессе работы, когда происходит интенсивное потребление АТФ, активность фосфофруктокиназы увеличивается, что приводит к интенсификации Г., а следовательно, и к усиленному образованию АТФ. При диабете, голодании и других условиях, вызывающих переключение энергетического обмена на использование жиров, содержание цитрата в клетке может возрасти в несколько раз. Величина торможения фосфофруктокиназы цитратом достигает при этом 70-80%.
Следующий этап Г. катализирует фруктозодифосфатальдолаза (схема, реакция 4). Фруктозо-1,6-дифосфат расщепляется на две фосфотриозы: диоксиацетонфосфат и глицеральдегид-3-фосфат. Под влиянием триозофосфатизомеразы (схема, реакция 5) происходит взаимопревращение, фосфотриоз. Равновесие этой реакции сдвинуто в сторону образования диоксиацетонфосфата: на 96% диоксиацетонфосфата приходится всего 4% глицеральдегид-3-фосфата, но именно он и участвует в дальнейших превращениях в процессе Г. Благодаря высокой активности триозофосфатизомеразы преимущественное образование диоксиацетонфосфата не лимитирует скорости Г. в целом. Образованием глицеральдегид-3-фосфата (3-фосфоглицеринового альдегида) заканчивается первая стадия Г.
Вторая стадия Г. является общим путем превращения всех углеводов и рассматривается как наиболее сложная и важная часть процесса, приводящая к образованию АТФ. Центральной реакцией Г. является реакция гликолитической оксидоредукции, сопряженной с фосфорилированием,- реакция окисления 3-фосфоглицеринового альдегида (схема, реакция 6), катализируемая глицеральдегидфосфатдегидрогеназой. Этот фермент состоит из четырех идентичных субъединиц, каждая из которых представляет собой полипептидную цепь с 330 аминокислотными остатками. Каждая субъединица несет одну молекулу НАД+ и 4 свободные SH-группы. В ходе реакции, идущей в присутствии неорганического фосфата, НАД+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. При восстановлении НАД+ происходит связывание глицеральдегид-3-фос-фата с молекулой фермента за счет SH-групп последнего. Образовавшаяся связь, богатая энергией, непрочна и расщепляется под влиянием неорганического фосфата, при этом образуется 1,3-дисфосфоглицериновая к-та (1,3-дифосфоглицерат). Последующая реакция (схема, реакция 7) приводит к передаче богатого энергией фосфатного остатка на молекулу АДФ с образованием АТФ и 3-фосфоглицериновой к-ты (3-фосфоглицерата). Для реакции, катализируемой фосфоглицераткиназой, необходимы ионы двухвалентных металлов: Mg 2+ , Mn 2+ или Ca 2+ . Далее (схема, реакция 8) 3-фосфоглицериновая к-та превращается в 2-фосфоглицериновую к-ту (2-фосфоглицерат). Реакцию катализирует фосфоглицерат-фосфомутаза в присутствии двух кофакторов: иона Mg 2+ и 2,3-дифосфоглицериновой к-ты. Следующий этап Г.- образование фосфоенолпирувата, богатого энергией предшественника АТФ (схема, реакция 9). Превращение 2-фосфоглицериновой к-ты (2-фосфоглицерата) в фосфоенолпируват осуществляется в результате реакции дегидратации, катализируемой фосфопируват-гидратазой. Фермент, катализирующий эту реакцию, нуждается в Mg 2+ , Mn 2+ , Zn 2+ или Cd 2+ , антагонистами которых являются ионы Ca 2+ или Sr 2+ . Реакцию между фосфоенолпируватом и АДФ (схема, реакция 10) с образованием пировиноградной к-ты (пирувата) и АТФ катализирует пируваткиназа, требующая для проявления своей активности ионов Mg 2+ или Mn 2+ и K + ; Ca 2+ выступает как конкурентный антагонист этих ионов. Для максимальной активности пируваткиназа нуждается также в присутствии одновалентных катионов K + , Rb + или Cs + , антагонистами которых являются катионы Na + и Li + . Обратимое восстановление пирувата в молочную к-ту (лактат) за счет восстановленного НАД + (НАДН) является конечным этапом Г. (схема, реакция 11). Реакцию катализирует лактатдегидрогеназа (см.).
Благодаря трем необратимым реакциям - гексокиназной, фосфофруктокиназной и пируваткиназной Г. сам по себе является необратимым процессом (его равновесие сдвинуто в сторону образования молочной к-ты). На I стадии Г. затрачиваются две молекулы АТФ, на II стадии образуются четыре молекулы АТФ. Т. о., энергетическая эффективность Г. (всего две молекулы АТФ на одну молекулу глюкозы) сравнительно низка. Тем не менее роль Г. велика, т. к. только благодаря ему организм может осуществлять ряд физиол, функций в условиях недостаточного снабжения тканей и органов кислородом. Такие условия создаются, напр., в энергично работающей скелетной мышце. Присутствие кислорода тормозит Г. (явление, называемое эффектом Пастера - см. Пастера эффект). В сердечной мышце в процессах образования энергии гликолитический путь распада углеводов занимает небольшое место. Активность ферментов Г. в сердце значительно ниже, чем в скелетных мышцах. Реальная скорость Г. меняется в зависимости от снабжения сердечной мышцы кислородом и интенсивности в ней окислительных процессов. Но даже при наиболее оптимальных условиях снабжения кислородом в мышце сердца всегда идет Г. Субстраты гликолитических реакций (фосфорилированные сахара, пируват, молочная к-та) используются сердечной мышцей в процессах пластического обмена веществ и в цикле Трикарбоновых к-т (см. Трикарбоновых кислот цикл) в качестве субстратов окисления. Большую роль Г. приобретает в сердце в условиях дефицита кислорода. Бурный аэробный Г. происходит в опухолях, где он является основным источником энергии. Опухолевые ткани характеризуются отсутствием эффекта Пастера. В них регулирующая роль фосфофруктокиназы утрачивается.
Нормальное течение Г. возможно только в том случае, если в ткани присутствуют АДФ, субстраты для фосфоглицераткиназной и пируваткиназной реакций, а также НАД и неорганический фосфат, необходимые для реакции гликолитической оксидоредукции (угнетение гликолитической оксидоредукции в сердечной мышце, обусловленное уменьшением содержания НАД, наблюдалось в условиях экспериментального миокардита). Основной, лимитирующей скорость Г. реакцией является реакция, катализируемая фосфофруктокиназой (см. схему, реакция 3). Вторым этапом, лимитирующим скорость и регулирующим Г., после фосфофруктокиназной реакции является гексокиназная реакция (см. схему, реакция 1). Широкий изоферментный спектр этого фермента обусловливает возможность тонкой регуляции Г. на его начальном, пусковом этапе. Динамичный характер связи гексокиназы с митохондриями и микросомами, а также изменения свойств этого фермента при взаимодействии с субклеточными структурами делают механизм регуляции Г. очень чувствительным.
Отсутствие регулирующей роли фосфофруктокиназы и крайне высокая активность гексокиназы превращают злокачественную опухоль в мощный насос, непрерывно извлекающий глюкозу из организма. При этом интенсивность Г. такова, что перепад между концентрацией глюкозы в артериальной крови и ткани опухоли достигает 60-80 мг% (артериальная кровь) против нуля (опухолевая ткань).
В норме контроль Г. осуществляется также лактатдегидрогеназой (ЛДГ) и ее изоферментами (см. Лактатдегидрогеназа), которые характеризуются специфической локализацией в органах и тканях. В тканях с аэробным метаболизмом (ткани сердца, почек, эритроциты) преобладают ЛДГ-1 и ЛДГ-2. Эти изоферменты ингибируются даже небольшими концентрациями пирувата, что препятствует образованию молочной к-ты и способствует более полному окислению пирувата в цикле Трикарбоновых к-т. В тканях человека, в значительной степени зависимых от энергии, образующейся в процессе Г. (скелетные мышцы), главными изоферментами ЛДГ являются ЛДГ-4 и ЛДГ-5. Активность ЛДГ-5 максимальна при тех концентрациях пирувата, которые ингибируют ЛДГ-1. Преобладание изоферментов ЛДГ-4 и ЛДГ-5 обусловливает интенсивный анаэробный Г. с быстрым превращением пирувата в молочную к-ту. Заметное увеличение относительного содержания ЛДГ-5 было отмечено при адаптации организмов и клеток в культурах к гипоксии. Во многих тканях человека (ткани селезенки, поджелудочной и щитовидной желез, надпочечников, лимф, узлов) преобладает изофермент ЛДГ-3. В тканях эмбриона и плода человека присутствуют все 5 изо-ферментов лактатдегидрогеназы, среди которых преобладает ЛДГ-3. Вскоре после рождения у ребенка картина распределения изоферментов в органах и тканях становится такой же, как и у взрослого человека. Изменение изоферментного спектра в эмбриогенезе особенно выражено в скелетных мышцах. При различных миопатиях (см.) наблюдается аномальное распределение изоферментов ЛДГ: увеличение одних и уменьшение или даже полное исчезновение других. При прогрессирующей мышечной дистрофии (болезнь Дюшенна) преобладают изоферменты ЛДГ-1, ЛДГ-2 и ЛДГ-3. При других формах мышечной дистрофии (миотоническая дистрофия, дерматомиозит, болезнь Верднига - Гоффманна) характерно уменьшение или даже отсутствие ЛДГ-5 в скелетных мышцах, что коррелирует со сниженным образованием молочной к-ты у больных этими формами миопатий после физ. работы. При ряде патол, состояний благодаря увеличению проницаемости клеточных мембран изо-ферменты лактатдегидрогеназы в избыточном количестве поступают в кровь. Активность лактатдегидрогеназы и характер распределения ее изоферментов в сыворотке крови специфически изменяются при инфаркте миокарда (см.), заболеваниях печени и желчевыводящих путей, ревматизме (см.). В клинике для дифференциальной диагностики этих заболеваний применяют простые методы определения относительного распределения изоферментов лактатдегидрогеназы в сыворотке крови, основанные на их различной электрофоретической подвижности.
В организме человека и животных существуют ферментативные механизмы, обеспечивающие протекание Г. в обратном направлении, т. е. синтез глюкозы, а также гликогена из молочной к-ты. Этот процесс носит название глюконеогенеза; он интенсивно протекает в печени, куда в больших количествах током крови доставляется молочная к-та. Энергия для осуществления этого процесса образуется также в печени в результате полного окисления нек-рой части (ок. 15%) молочной к-ты. Предшественниками глюкозы в глюконеогенезе могут быть пируват или любое соединение, превращающееся в процессе катаболизма в пируват или один из промежуточных продуктов цикла Трикарбоновых к-т, а также так наз. гликогенные аминокислоты.
Большинство стадий глюконеогенеза представляет собой обращение реакций Г. Три реакции Г.- гексокиназная, фосфофруктокиназная и пируваткиназная - необратимы, поэтому глюконеогенез идет в обход этих реакций.
Первую реакцию глюконеогенеза - превращение молочной к-ты в пировиноградную - катализирует лактатдегидрогеназа. Синтез фосфоенолпирувата из пирувата осуществляется в несколько этапов. Первый этап локализуется в митохондриях.
Пируват под влиянием пируваткарбоксилазы (КФ 6.4.1.1), активной только в присутствии ацетилкофермента А, карбоксилируется при участии CO 2 с образованием оксалоацетата. В реакции участвует АТФ, поэтому продуктами реакции наряду с оксалоацетатом являются АДФ и ортофосфат:

Оксалоацетат в результате декарбоксилировании и фосфорилирования под влиянием фосфопируваткарбоксилазы (КФ 4.1.1.32) превращается в фосфоенол пируват. Донором фосфатного остатка в реакции служит гуанозинтрифосфат или инозинтрифосфат:

Фосфопируваткарбоксилаза присутствует как в гиалоплазме, так и в митохондриях, но распределение фермента у человека и животных различно. У морских свинок, кроликов, овец, коров и у человека фосфопируваткарооксилаза присутствует в обеих фракциях. В эмбриональной печени крыс и морских свинок, не способной к глюконеогенезу, присутствует только митохондриальный фермент. В гиалоплазме активность фосфопируваткарбоксилазы появляется только в постнатальный период; одновременно печень становится способной к глюконеогенезу.
Поскольку в глюконеогенезе участвует фосфопируваткарбоксилаза превращение оксалоацетата в фосфоенолпируват происходит именно в гиалоплазме. Оксалоацетат, образовавшийся в митохондриях, не может перейти в гиалоплазму, т. к. мембрана митохондрий для него непроницаема. В митохондриях оксалоацетат восстанавливается в яблочную к-ту (малат), к-рая способна диффундировать из митохондрий в гиалоплаз-му, где и окисляется с образованием оксалоацетата, который, в свою очередь, превращается в фосфоенол пируват.
Последующие реакции глюконеогенеза, катализируемые ферментами Г., приводят к образованию фруктозо-1 ,6-дифосфата. Превращение фруктозо-1 ,6-дифосфата во фруктозо-6-фосфат, а затем и глюкозо-6-фосфата в глюкозу катализируют специфические фосфатазы, гидролитически отщепляющие неорганический фосфат.
При глюконеогенезе фруктозо-1,6-дифосфатаза (гексозодифосфатаза; КФ 3.1.3.11) катализирует ключевую реакцию D-фруктозо-1,6-дифосфат + H 2 O -> D-фруктозо-б-фосфат + ортофосфат) и соответственно действие, к-рое оказывает на нее АТФ и АМФ, противоположно их действию на фосфофруктокиназу (см. выше): гексозодифосфатаза активируется под влиянием АТФ и ингибируется АМФ. Когда величина отношения АТФ/АДФ низка, в клетке происходит расщепление глюкозы, когда эта величина высока - расщепление глюкозы прекращается. В аэробных условиях значительно эффективнее, чем в анаэробных, из клетки удаляется неорганический фосфат й АДФ и накапливается АТФ, что приводит к подавлению Г. и стимуляции глюконеогенеза. Пируваткарбоксилаза также чувствительна к величине отношения АТФ/АДФ, т. к. ингибируется АДФ. Ацетил-КоА активирует пируваткарбоксилазу.
В регуляции Г. и глюконеогенеза большую роль играет инсулин (см.). При недостаточности его происходит повышение концентрации глюкозы в крови (гипергликемия), избыточное выведение глюкозы с мочой (глюкозурия) и уменьшение содержания гликогена в печени. При этом мышцы утрачивают способность использовать в процессе Г. глюкозу крови. В печени при общем снижении интенсивности биосинтетических процессов (биосинтеза белков, биосинтеза жирных к-т из глюкозы) наблюдается усиленный синтез ферментов глюконеогенеза. При введении инсулина больным диабетом все перечисленные метаболические нарушения исчезают: нормализуется проницаемость для глюкозы мембран мышечных клеток, восстанавливается соотношение между Г. и глюконеогенезом. Инсулин контролирует эти процессы на генетическом уровне как регулятор синтеза ферментов. Он является индуктором образования ключевых ферментов Г.: гексокиназы, фосфофруктокиназы и пируваткиназы. Одновременно инсулин действует как репрессор синтеза ферментов глюконеогенеза.
Клин, признаки преобладания Г. над аэробной фазой распада углеводов наблюдаются чаще всего при гипоксических состояниях, обусловленных различными нарушениями кровообращения или дыхания, высотной болезнью, анемией, понижением активности системы тканевых окислительных ферментов при некоторых инфекциях и интоксикациях, гипо- и авитаминозами, в результате относительной гипоксии при чрезмерной мышечной работе. При усилении Г. происходит накопление пирувата и лактата с соответствующим закислением тканей, изменением кислотно-щелочного равновесия, уменьшением щелочных резервов. У больных сахарным диабетом активация процессов Г. и недостаточный ресинтез лактата в гликоген печени также нередко приводят к увеличению содержания в крови лактата и пирувата; в этих случаях ацидоз может достигать высокой степени с развитием диабетической молочнокислой комы. Торможение ресинтеза гликогена из лактата и пирувата, образовавшихся в результате Г., наблюдается при поражениях паренхимы печени (поздние стадии гепатита, цирроз печени и т. п.), поэтому увеличение содержания в сыворотке крови лактата и пирувата может служить показателем нарушения функции печени.
Высокая интенсивность Г. в опухолевых тканях используется для определения чувствительности опухолей к нек-рым противоопухолевым препаратам: подавление Г. в срезах опухоли под влиянием исследуемого химиопрепарата свидетельствует о чувствительности к нему данной опухоли.
Библиография: Дэгли С. и Никольсон Д. Е. Метаболические пути, пер. с англ., М., 1973, библиогр.; Л e н и н д-жер А. Биохимия, пер. с англ., М., 1976; Проблемы медицинской химии, под ред. В. С. Шапота и Э. Г. Ларского, М., 1973, библиогр.; УилкинсонДж. Изофер-менты, пер. с англ., М., 1968.
Г. А. Соловьева, Г. К. Алексеев.