Вадим валерьевич корпачев целебная фауна. Белки, их строение и функции
Глава III. БЕЛКИ
§ 6. АМИНОКИСЛОТЫ КАК СТРУКТУРНЫЕ ЭЛЕМЕНТЫ БЕЛКОВ
Природные аминокислоты
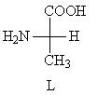
Аминокислоты в живых организмах встречаются преимущественно в составе белков. Белки построены в основном двадцатью стандартными аминокислотами. Они являются a-аминокислотами и отличаются друг от друга строением боковых групп (радикалов), обозначаемых буквой R:
Разнообразие боковых радикалов аминокислот играет ключевую роль при формировании пространственной структуры белков, при функционировании активного центра ферментов.
Структура стандартных аминокислот приведена в конце параграфа в табл.3. Природные аминокислоты имеют тривиальные названия, оперировать которыми при записях структуры белков неудобно. Поэтому для них введены трехбуквенные и однобуквенные обозначения, которые также представлены в табл.3.
Пространственная изомерия
У всех аминокислот, за исключением глицина, a-углеродный атом является хиральным, т.е. для них характерна оптическая изомерия. В табл. 3 хиральный атом углерода обозначен звездочкой. Например, для аланина проекции Фишера обоих изомеров выглядят следующим образом:
Для их обозначения, как и для углеводов, используется D, L-номенклатура. В состав белков входят только L-аминокислоты.
L- и D-изомеры могут взаимно превращаться друг в друга. Этот процесс называется рацемизацией.
Интересно знать! В белке зубов – дентине – L -аспарагиновая кислота самопроизвольно рацемизуется при температуре человеческого тела со скорость 0,10 % в год. В период формирования зубов в дентине содержится только L -аспарагиновая кислота, у взрослого же человека в результате рацемизации образуется D -аспарагиновая кислота. Чем старше человек, тем выше содержание D-изомера. Определив соотношение D- и L-изомеров, можно достаточно точно установить возраст. Так были изобличены жители горных селений Эквадора, приписывавшие себе слишком большой возраст.
Химические свойства
Аминокислоты содержат амино- и карбоксильную группы. В силу этого они проявляют амфотерные свойства, то есть свойства и кислот и оснований.
При растворении аминокислоты в воде, например, глицина, его карбоксильная группа диссоциирует с образованием иона водорода. Далее ион водорода присоединяется за счет неподеленной пары электронов у атома азота к аминогруппе. Образуется ион, в котором одновременно присутствуют положительный и отрицательный заряды, так называемый цвиттер-ион:
Такая форма аминокислоты является преобладающей в нейтральном растворе. В кислой среде аминокислота, присоединяя ион водорода, образует катион:
В щелочной среде образуется анион:
Таким образом, в зависимости от рН среды аминокислота может быть положительно заряженной, отрицательно заряженной и электронейтральной (при равенстве положительных и отрицательных зарядов). Значение рН раствора, при котором суммарный заряд аминокислоты равен нулю, называется изоэлектрической точкой данной аминокислоты. Для многих аминокислот изоэлектрическая точка лежит вблизи рН 6. Например, изоэлектрические точки глицина и аланина имеют значения 5,97 и 6,02 соответственно.
Две аминокислоты могут реагировать друг с другом, в результате чего отщепляется молекула воды и образуется продукт, который называется дипептидом :
Связь, соединяющая две аминокислоты, носит название пептидной связи . Если пользоваться буквенными обозначениями аминокислот, образование дипептида можно схематически представить следующим образом:
Аналогично образуются трипептиды, тетрапептиды и т.д.:
H 2 N – лиз – ала – гли – СООН – трипептид
H 2 N – трп – гис – ала – ала – СООН – тетрапептид
H 2 N – тир – лиз – гли – ала – лей – гли – трп – СООН – гептапептид
Пептиды, состоящие из небольшого числа аминокислотных остатков, имеют общее название олигопептиды .
Интересно знать! Многие олигопептиды обладают высокой биологической активностью. К ним относится ряд гормонов, например, окситоцин (нанопептид) стимулирует сокращение матки, брадикинин (нанопептид) подавляет воспалительные процессы в тканях. Антибиотик грамицидин С (циклический декапептид) нарушает регуляцию ионной проницаемости в мембранах бактерий и тем самым убивает их. Грибные яды аманитины (октапептиды), блокируя синтез белка, способны вызвать сильное отравление у человека. Широко известен аспартам - метиловый эфир аспартилфенилаланина. Аспартам имеет сладкий вкус и используется для придания сладкого вкуса различным продуктам, напиткам.
Классификация аминокислот
Существует несколько подходов к классификации аминокислот, но наиболее предпочтительной является классификация, основанная на строении их радикалов. Выделяют четыре класса аминокислот, содержащих радикалы следующих типов; 1) неполярные (или гидрофобные); 2) полярные незаряженные; 3) отрицательно заряженные и 4) положительно заряженные:
К неполярным (гидрофобным) относятся аминокислоты с неполярными алифатическими (аланин, валин, лейцин, изолейцин) или ароматическими (фенилаланин и триптофан) R-группами и одна серусодержащая аминокислота – метионин.
Полярные незаряженные аминокислоты в сравнении с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды. К ним относятся аминокислоты, содержащие полярную НО-группу (серин, треонин и тирозин), HS-группу (цистеин), амидную группу (глутамин, аспарагин) и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам. Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин, в ионизированном виде они имеют суммарный положительный заряд:
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные . К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
Десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в человеческом организме. Остальные должны содержаться в нашей пище. К ним относятся аргинин, валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин и гистидин. Эти аминокислоты называются незаменимыми. Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Интересно знать! Исключительно важную роль играет сбалансированность питания человека по аминокислотам. При недостатке незаменимых аминокислот в пище организм саморазрушается. При этом страдает в первую очередь головной мозг, что приводит к различным заболеваниям центральной нервной системы, психическим расстройствам. Особенно уязвим молодой растущий организм. Так, например, при нарушении синтеза тирозина из фенилаланина у детей развивается тяжелое заболевание финилпировиноградная олигофрения, вызывающее тяжелую умственную отсталость или гибель ребенка.
Таблица 3
Стандартные аминокислоты
|
Аминокислота (тривиальное название) |
Условные обозначения |
Структурная формула |
||
|
Латинское |
||||
|
трехбук- венное |
однобук-венное |
|||
|
НЕПОЛЯРНЫЕ (ГИДРОФОБНЫЕ) |
||||
|
Изолейцин |
|
|||
|
Фенилаланин |
||||
|
Триптофан |
|
|||
|
Метионин |
||||
|
ПОЛЯРНЫЕ НЕЗАРЯЖЕННЫЕ |
||||
|
Аспарагин |
|
|||
|
Глутамин | ||||
В практике здравоохранения широкое применение нашел спленин. Этот препарат селезенки был получен в 1945 г. в Лаборатории экспериментальной эндокринологии (Институт экспериментальной биологии и патологии им. А. А. Богомольца) академиком АН УССР В. П. Комиссаренко. Химическая природа спленина изучена довольно подробно. В препарате обнаружено большое количество аминокислот, пептид, содержащий 13 аминокислот, множество жирных кислот, а также липиды, микроэлементы и витамины. Активное начало спленина еще не выделено.
Эксперименты на различных видах животных показали выраженное детоксикационное действие препарата.
Испытание действия спленина при токсикозах на ранних сроках беременности, проведенное в различных учреждениях нашей страны, показало, что он высокоэффективен при лечении этой патологии. Кроме того, применяя спленин при лечении осложнений у больных после рентгенотерапии, медики заметили, что уже после 3 – 4 инъекций препарата общее состояние человека значительно улучшается: прекращаются тошнота и рвота, головные боли, появляется аппетит, нормализуется сон. Благодаря ярко выраженным детоксикационным свойствам препарат оказывает выраженный терапевтический эффект при лечении различных форм гепатитов и функциональных нарушений печени, тиреотоксикоза, недостаточности паращитовидных желез, шизофрении и диабета.
Исследователями была обнаружена еще одна способность препарата – угнетать проявление аллергических реакций. Спленин оказывал выраженный терапевтический эффект при лечении аллергического насморка, крапивницы и аллергических дерматитов.
Многие эффекты спленина можно объяснить его мембранотропными свойствами, т. е. способностью стабилизировать клеточную мембрану. Так, эритроциты, обработанные этим препаратом, менее чувствительны к гипотоническому шоку. Механизм многих эффектов спленина изучен еще недостаточно. Не выяснена химическая природа биологически активных факторов, входящих в его состав. Изучение препарата продолжается.
В настоящее время из селезенки выделено только два пептида, структура которых установлена: 1. Тафцин, биосинтез которого происходит в селезенке в виде лейкокинина, а окончательная структура формируется на поверхности мембран лейкоцитов. В настоящее время тафцин синтезирован, а также получены его биологически активные аналоги. 2. Фактор, напоминающий по своей структуре тимопоэтин и названный спленином. Он так же,как и тимопоэтин, состоит из 49 аминокислот и имеет активный участок из пяти
Тир-Лиз-Про-Арг
Тафцин
аминокислот, который был назван спленопентином. Спленопентин отличается от тимопентина одной аминокислотой.
Арг-Лиз-Асп-Вал-Тир
Тимопентин
Арг-Лиз-Глу-Вал-Тир
Спленопентин
Биологические эффекты спленопентина и тимопентина имеют существенные различия.
Изучением гуморальных факторов селезенки занимаются в Киевском научно-исследовательском институте эндокринологии и обмена веществ. В последние годы здесь получен ряд новых важных данных, позволивших значительно расширить наши представления о физиологии и патологии функций селезенки, о значении тех явлений, которые возникают при ее нарушении. Однако многие загадки этого органа остаются еще неразгаданными.
Парадоксы животного мира
При изучении биологически активных веществ различной природы и различного происхождения становится очевидной условность их разделения на медиаторы, обеспечивающие межклеточные связи, гормоны, передающие сигналы на более далекие расстояния, феромоны, являющиеся средствами общения между организмами, и токсины, служащие животным для защиты.
Анализ строения биологических регуляторов показывает, что одно и то же соединение у различных видов животного царства может выполнять разную роль. Люлиберин в системе гипоталамус – гипофиз выступает в роли гормона, в то время как тот же пептид в симпатическом ганглии лягушки является нейромедиатором. Феромон спаривания у дрожжей α-фактор связывается с рецепторами гипофиза млекопитающих и при действии на гонадотропы в тканевой культуре вызывает секрецию лютеинизирующего гормона. Изучение его химического состава показало, что он имеет с люлиберином обширную гомологию последовательностей аминокислот.
Структурная гомология играет важную роль во взаимодействии биостимулятора с рецептором, в то время как физиологический ответ определяется функциональной системой, на которую он действует.
В 1931 г. фон Эйлер и Гэддум обнаружили в экстрактах мозга и кишечника животных вещество, которое при введении наркотизированному кролику вызывало снижение кровяного давления и усиливало сокращение изолированного кишечника. Его назвали «вещество Р». В дальнейшем было установлено, что оно является нейромедиатором чувствительных нейронов и содержание его в задних (чувствительных) корешках спинного мозга превышает в два раза концентрацию в передних корешках. Структура вещества была определена через 40 лет, и оказалось, что она сходна со строением таких пептидов, как физалемин, выделенный из кожи южноафриканской лягушки, и эледозин, обнаруженный в слюнных железах осьминогов.
Арг-Про-Лиз-Про-Гли-Гли-Фен-Гли-Лей-Мет-NH 2
Вещество Р
Пироглу-Ала-Асп-Про-Асп-Лиз-Феп-Три-Гли-Лей-Мет-NH 2
Физалемин
Пироглу-Про-Сер-Лиз-Асп-Ала-Фен-Илей-Гли-Гли-Лей-Мет-NH 2
Эледозин
Эти три вещества имеют сходную структуру, включающую гомологичные участки пептидов, в то время как получены они из разных источников и выполняют разные функции.
В качестве другого примера можно привести пептид бомбезин, который был выделен из кожи европейской лягушки Bombina bombina, а затем обнаружен в Р-клетках слизистой желудка и двенадцатиперстной кишки млекопитающих. Бомбезин выполняет функцию освобождающего фактора при выделении гастрина и холецистокинина. В связи с этим он вызывает стимуляцию желудка и поджелудочной железы, сокращает желчный пузырь и усиливает движение кишечника. С помощью иммунологических методов исследования было установлено, что в нервных клетках коры головного мозга, гипоталамуса, гипофиза, шишковидной железы и мозжечка, кроме обычных гормонов органов пищеварения, содержится и бомбезин. Он не имеет себе равных среди известных веществ по способности воздействовать на терморегуляцию. При введении его в гипоталамическую структуру мозга крысы при 4° происходит снижение температуры тела – она оказывается на несколько градусов ниже, чем обычно у крысы. При 36° температура тела повышалась. Этот пептид был эффективен только при введении в гипоталамус, там, где расположен центр терморегуляции. С этим свойством, вероятно, связано его участие в зимней спячке некоторых животных. Введение бомбезина в желудочки мозга крысы вызывало изменение поведения и снижение болевой чувствительности. Кроме того, он увеличивает содержание глюкозы в крови, повышает концентрацию глюкагона, снижает уровень инсулина и угнетает потребление пищи голодными крысами. Это единственный пептид, который регулирует чувство насыщения, так как он влияет не на частоту приема пищи, а лишь на съеденное количество. Поступление бомбезина в желудочки мозга препятствовало возникновению язв желудка при стрессе. При этом снижалась секреция соляной кислоты и возрастало выведение слизи. Бомбезин стимулирует также секрецию соматотропного и лактотропного гормонов. Его свойства позволяют предполагать, что он является нейромедиатором в нервных структурах.
В зарубежном журнале «Biochem. J.» (1981. Т. 197, № 3) опубликовано сообщение, что из голов падальной мухи Calliphora vomitoria выделено вещество, подобное полипептиду поджелудочной железы млекопитающих, а в другом иностранном журнале (Insect. Biochem. 1977. Т. 7. № 5 – 6) описаны белковые фракции, выделенные из жуков Adalia bipunctata, бабочек Galleria mellonella и пчел, которые по своим свойствам близки к соматотропному гормону сыворотки крови быка.
Спешл фо 218 (=^_^ =)
За основу взяты старые задачи- 113 штук. Те, которые выбросили из нового списка, просто не буду печатать. Хотя некоторых у меня просто напросто нет. Ответы здесь конечно не айс, но все равно, хоть что-то взять отсюда можно.
В: В пептидной цепи между радикалами аминокислот могут возникать химические связи. Выберите пары аминокислот, способные их образовать: а) вал-изолей; б) цис-цис; в) глу-лиз; г) фен-асп. Ответ обоснуйте.
О: а) образуют связь – гидрофобная связь, т.к. обе аминокислоты гидрофобные
б) образуют связь – дисульфидная связь за счет SH
в) образуют связь – ионная связь, т.к. кислая и основная аминокислоты
г) не образуют связи
2. В: Напишите формулу трипептида: лиз-арг-гис. В какой среде находится его ИЭТ? Ответ обоснуйте.
О: ИЭТ – это значение pH, при котором заряд белка стремится к нулю. В этом трипептиде все аминокислоты основные. А значит ИЭТ в щелочной среде.
3: В: Напишите формулу трипептида: глу-асп-ала. Определите его заряд в нейтральной среде. Как изменится заряд в кислой среде? Растворимость? Почему?
О: Глу и асп – кислые аминокислоты, ала – гидрофобная. При рН =7 заряд трипептида отрицательный. В кислой среде (при добавлении протонов Н +) заряд будет уменьшаться, т.е стремиться к ИЭТ. При уменьшении заряда уменьшается и растворимость.
4. В: Трипептид: вал-лей-ала. Уточните его способность растворяться в воде. Почему?
О: Трипептид образован гидрофобными аминокислотами, между радикалами которых образуются гидрофобные связи. Поэтому в воде не растворяется.
5. В: Два пациента больны дизентерией. У одного величина белкового коэффициента – 0,9, у другого – 1,9. Какова тактика врача в обоих случаях?
О: Дизентерия – это инфекционное заболевание. Обусловленное внедрением в макроорганизм микроорганизма.
БК – это соотношение альбуминов к глобулинам в сыворотке крови. БК= [А]/[Г]=1,5 – 2,3. При внедрении микроорганизма запускается гуморальный иммунитет, что обуславливает выработку гамма-глобулинов. При увеличении глобулинов в крови значение БК уменьшается – значит организм борется с инфекцией- как у первого пациента. Во втором случае БК=1,9, т.е гамма-глобулины не вырабатываются, а значит организм не борется с микроорганизмом. Следовательно, состояние хуже у второго больного. В первом случае – врач назначает антибиотики, которые действуют на мембрану микроба, проникают внутрь клетки, действуют на ДНК микроорганизма, тем самым не позволяя размножаться. Во втором случае назначают иммуностимуляторы- взрослым, а детям и старикам – вводят готовые антитела. Так же и в 1ом и во 2ом случаях дают водно-солевые растворы для предотвращения обезвоживания.
6. В: Объясните механизм образования кефира из молока. Почему белки кефира лучше усваиваются детским организмом?
О: Кефир – продукт кисломолочного брожения, как следствие работы микроорганизмов, продуктами питания которых являются углеводы. Конечный продукт этого процесса – молочная кислота. В молоке лактоза подвергается брожения с образованием молочной кислоты. При этом меняется рН с нейтральной на кислую. Подавляющее большинство белков – кислые, в том числе и белки молока. При изменении рН меняется и заряд белков – он уменьшается, уменьшается также и растворимость. Молочная кислота действует на химические связи между радикалами аминокислот белков молока, рвет эти связи – т.е происходит денатурация) белки разворачиваются). В кефире белки не осаждаются, а остаются на поверхности. Детьми белки кефира, т.к. они находятся в развернутом виде, усваиваются лучше – т.к. доступны пептидные связи.
7. В: Какие белки плазмы крови альбумины или глобулины быстрее движется при электрофорезе? Почему?
О: Электрофорез – это движение частиц раствора, помещенного в электрическое поле. Скорость движения частиц прямо пропорциональна заряду, и обратно пропорциональна массе частиц. Альбумины и глобулины – кислые белки, значит имеют «-» заряд, но у альбуминов величина этого заряда выше. По массе: альбумины меньше, чем глобулины. Значит по 2м критериям видно, что альбумины при электрофорезе движется быстрее.
8. В: Где в медицине применяют способность белков к денатурации.?
О: Три направления медицины
А) ПРОФИЛАКТИКА: кварцевание, обработка хирургического поля, обработка кожи перед уколом, стерилизация.
Б) ЛЕЧЕНИЕ: химиотерапия – разрушение опухоли, остановка кровотечения – коагуляция (свертывание)
В) ДИАГНОСТИКА: осаждение белков для определения их количества, осаждение для определения количества других веществ в био.жидкостях.
9. В: Что лучше растворяется в воде нуклеиновые кислоты или нуклеопротеиды? Почему?
При уменьшении заряда, уменьшается и растворимость. Значит лучше растворяются в воде НК.
10. В: Чем опасны неумеренные попытки загореть?
О: При попытке загореть в организме увеличивается синтез меланина. Значит действие УФИ не очень предпочтительно. Если меланина в организме вырабатывается недостаточно, то УФ проникает в более глубокие слои кожи. Таким образом он действует на клетки кожи. А именно на их мембраны. В основе мембран клеток лежит билипидный слой, состоящий из ФЛ, ВЖК. А ВЖК имеют следующий тип строения: -С-С-С-.. т.е. цепь из углеродных атомов. А УФ луч – это сгусток энергии, который рвет эту цепь по гомолитическому типу распада связи, т.е. образуются свободные радикалы, имеющие неспаренный электрон. Именно эти радикалы и запускают ПОЛ. При этом процессе повреждаемся мембрана клетки, и УФ луч проникает внутрь. А внутри клетки с большом количестве находятся белки и НК, которые являются полимерами. При действии на них УФИ – происходит денатурация. Последствия: ожоги, опухоли. Так же при неумеренных попытках загореть провоцируется избыточный синтез витамина D, чо может привести к гипервитаминозу, последствиями чего является увеличения концентрации Са2+ в крови, и он может откладываться в тканях и органах, нарушая их деятельность.
11. : В: У пепсина ИЭТ равна 1. Какие аминокислоты преобладают в его молекуле?
О: Кислые аминокислоты.
12: В: Приходилось ли вам наблюдать за работой ферментов? Приведите примеры.
О: Углеводы: брожение – молочнокислое, спиртовое, лимоннокислое, уксуснокислое и т.д. (йогурты, кефир, квас, квашение капусты, кислое тесто)
Липиды: прогоркание сливочного масла
Белки: гниение (тухлые яйца, испорченные продукты, плесневелый сыр)
13. В: Напишите реакцию декарбоксилирования глутамата. Назовите класс фермента. Роль продукта.
О:

Продукт – гамма-аминомасляная кислота – тормозный медиатор. Фермент- ГЛУТАМАТДЕКАРБОКСИЛАЗА. Класс фермента – лиазы (рвет –С-С- связь)
14. В: Укажите класс фермента альдолазы гликолиза. Ответ обоснуйте
О: Класс фермента- лиаза. Рвет –С-С- связь. С помощью этого фермента фруктоза-1,6-дифосфат превращается в ГА-3-Ф и ДГАФ.

в новых задачах нет!
В: Что опаснее ожог кислотой или щелочью (при их равной ионной силе)? Ответ поясните.
О: Опаснее ожог щелочью. И кислота, и щелочь при попадании на кожу вызывают денатурацию белков ткани. Но кислота обладает свойством – гигроскопичности. Это свойство обуславливает захват воды из ткани, т.е при попадании на кожу кислота как бы вытягивает всю воду из ткани и остается сухая корочка. Она и является препятствием для дальнейшего проникновения кислоты в более глубокие слои кожи. Щелочь же таким свойством не обладает и поэтому может вызвать денатурацию белков более глубоких слоев кожи.
В: С какой целью кварцуют операционные? Механизм явления.
О: Кварцевание – воздействие УФИ на какую-либо поверхность. Кварцевание используют для обезвреживания микроорганизмов. В основе этого лежит денатурация белков этих микроорганизмов, причем в первую очередь рвутся гидрофобные взаимодействия радикалов аминокислот в пептидах, что «открывает» пептидные связи первичной структуры белка.
В: Первая помощь при отравлении солями тяжелых металлов. Ответ поясните
О: Главная задача – предотвратить всасывание этих солей. Для этого внутрь вводят раствор природных белков. Чаще это молоко. Белки молока связываются с солями, что вызывает их денатурацию и они осаждаются на слизистую, уменьшая доступ солей к слизистой. После этого делают промывание.
В: Сколько глюкозы в норме в моче и почему?
О: В норме глюкозы в моче нет, т.к. она полностью реабсорбируется почечными канальцами. В первичной моче есть глюкоза, но затем она полностью реабсорбируется, причем реабсорбция идет путем активного транспорта, т.е. с затратой энергии. При хронической гипергликемии (9-10 ммоль/л) уменьшается процент реабсорбции этого соединения, т.к. не хватает энергии и может развиться глюкозурия.
В: Назовите фермент, принимающий участи в синтезе и распаде гликогена. Формулы реакций.
О:

Фермент – ФОСФОГЕКСОМУТАЗА.
21.В: Чем грозит ранее и неумеренное употребление легкоусвояемых углеводов у детей? Почему?
О: Легкоусвояемые углеводы детям можно давать с 5 лет. До этого срока нельзя, т.к. чревато:
а) диатез,
б) кариес,
в) в крови наблюдается гипергликемия – а значит выработка инсулина, что ведет к липогенезу в липоцитах - как следствие ожирение, в печени липогенез – жировая инфильтрация (перерождение) печени,
г) может развиться СД II типа,
д) увеличивается синтез ХС – атеросклероз,
е) увеличенное поступление ХС в печень, выводится с желчью, если его содержание в желчи превышено – осаждение, желчные камни.
В: Разница в использовании гликогена в мышцах и печени.

23.: Почему блок глюкозо-6-фосфатазы обуславливает стимуляцию синтеза гликогена? Пример патологии.
О: Дефицит глюкозо-6-фосфатазы составляет основу болезни Гирке, или гликогеноза типа 1. Недостаточность этого фермента приводит к невозможности превращения глюкозо-6-фосфата в глюкозу, что сопровождается накоплением гликогена в печени и почках. Болезнь наследуется по аутосомно-рецессивному типу.
Поступление глюкозы в организм с пищей, в принципе, дает возможность поддерживать в крови нормальный уровень глюкозы, однако для этого поступление пищи, содержащей глюкозу, должно быть практически непрерывным. В реальных условиях существования, т. е. при отсутствии непрерывного поступления глюкозы, в здоровом организме последняя депонируется в виде гликогена, который при необходимости используется при его полимеризации.
Первичное нарушение при болезни Гирке происходит на генетическом уровне. Оно состоит в полной или почти полной неспособности клеток продуцировать глюкозо-6-фосфатазу, обеспечивающую отщепление свободной глюкозы от глюкозо-6-фосфата. В результате этого гликогенолиз прерывается на уровне глюкозо-6-фосфата и дальше не идет. Дефосфорилирование с участием глюкозо-6-фосфатазы является ключевой реакцией не только гликогенолиза, но и глюконеогенеза, который, таким образом, при болезни Гирке также прерывается на уровне глюкозо-6-фосфата. Возникновение устойчивой гипогликемии, которая в реальных условиях неизбежна из-за непоступления в кровь глюкозы как конечного продукта гликогенолиза и глюконеогенеза, в свою очередь приводит к постоянной повышенной секреции глюкагона как стимулятора гликогенолиза. Глюкагон, однако, в условиях прерывания этого процесса способен лишь без пользы для организма непрерывно стимулировать его начальные стадии.
13.. За счет каких связей может образоваться сополимер из двух нижепредставленных пептидов?
а) ала-мет-арг-цис-ала-гли-сер-гли-цис-тре;
б) лиз-глу-арг-цис-арг-гли-тре-сер-лиз-тре-глу-сер.
14. Как, используя биуретовый метод определения белка и сульфат аммония, установить соотношение между альбуминами и глобулинами сыворотки крови?
15. Отношение количества альбуминов к количеству глобулинов в сыворотке крови больного равно 1,5. Рассчитайте содержание глобулинов, если концентрация альбуминов равна 5,0 г%.
16. Назовите две основные конфигурации белковой молекулы и укажите различия между ними.
17. На каком уровне пространственной организации различают белки глобулярные и фибриллярные?
18. Назвать важнейшие группы основных белков.
19. Почему протамины и гистоны отличаются основным характером?
20. Почему протамины и гистоны коагулируют при сильном нагревании только в сильно щелочной среде?
ЗАНЯТИЕ 3 «Химия сложных белков. Определение компонентов фосфо- и нуклеопротеидов»
Цель занятия : ознакомиться с классификацией и структурой сложных белков, в особенности нуклеопротеидов, которым принадлежит ведущая роль в хранении и передаче генетической информации (ДНК и РНК), а также с важнейшим хромопротеидов (гемоглобином).
Студент должен знать :
1. Классы сложных белков, принцип их деления на классы, принцип номенклатуры
2. Химическую природу простетических групп сложных белков.
3. Компоненты простетической группы нуклеопротеидов и хромопротеидов (в частности, гемоглобина).
4. Пространственную организацию нуклеиновых кислот.
5. Различия в составе и структуре РНК и ДНК
6.Функции ДНК и РНК, виды РНК, их локализацию.
7. Простетическую группу гемоглобина, её компоненты, роль железа в составе гема.
8. Факторы, воздействие которых может вызывать изменения структуры ДНК с информационными последствиями.
Студент должен уметь :
1. Построить (схематически) комплементарную цепь к участку заданного фрагмента одной из цепей ДНК.
2. Определить по результатам качественного анализа гидролизата нуклеиновых кислот, подвергалась гидролизу ДНК или РНК
3.Различать виды гемоглобина и использовать принятые для них обозначения (оксигемоглобин, восстановленный гемоглобин, карбоксигемоглобин и т.д.
4. Найти ошибки в представляемых для оценки отрезках якобы комплементарных цепей ДНК
Студент должен получить представление : о преимущественной локАлизации в организме человека сложных белков, их биологическом значении, об угрозах, которыми являются для существования видов мутагенные воздействия.
Аудиторная работа
Лабораторная работа (Определение компонентов фосфо-
И нуклеопротеидов)
1. Выделение казеина из молока. Казеин (один из фосфопротеидов) содержится в молоке в виде растворимой кальциевой соли, которая при подкислении распадается, и казеин выпадает в осадок. Избыток кислоты мешает осаждению, так как при значениях рН ниже 4,7 (изоэлектрическая точка казеина) молекулы белка перезаряжаются, и казеин вновь переходит в раствор.
Ход работы. К 2 мл молока добавить равный объем дистиллированной воды и 2 капли 10%-ной уксусной кислоты. Казеин, выпадающий в виде хлопьев, собрать на фильтре и промыть водой.
Гидролиз нуклеопротеидов
Ход работы. В круглодонную колбу поместить 1 г дрожжей, добавить 20 мл 10%-ного раствора серной кислоты и столько же дистиллированной воды. Колбу закрыть пробкой с обратным холодильником и кипятить под тягой 1,5 ч при слабом нагревании. Жидкость охладить, довести дистиллированной водой до исходного объема, фильтровать. Фильтрат использовать для следующих качественных реакций:
а) биуретовая реакция (для обнаружения полипептидов). К 5 каплям полученного гидролизата прибавить 10 капель 10%-ного раствора едкого натра и 1 каплю 1%-ного раствора сернокислой меди. Жидкость окрашивается в розовый цвет;
б) серебряная проба (для обнаружения пуриновых оснований). К 5 каплям гидролизата прилить 5 капель 2%-го аммиачного раствора азотнокислого серебра. Через 3-5 мин выпадает небольшой бурый осадок серебряных соединений пуриновых оснований;
в) качественная реакция Молиша (для обнаружения пентозной группировки). К 10 каплям гидролизата прилить 2 - 3 капли 1%-ного раствора тимола в этаноле, перемешать и по стенке опустить равный объем концентрированной серной кислоты - отчетливое красное кольцо;
г) молибденовая проба (для обнаружения фосфорной кислоты). К 5 каплям гидролизата прилить 5 капель молибденового реактива и кипятить несколько минут. Появляется лимонно-желтое окрашивание, а при охлаждении - желтый кристаллический осадок комплексного соединения фосфорномолибденовокислого аммония.
Дать обоснованные ответы предложенные ниже задания:
1. Какие структурные компоненты входят в состав ДНК? В какой последовательности связаны они между собой?
2. Построить комплементарную цепь к участку. представленного ниже фрагмента ДНК (- А - Г - Г - Ц - Т- Г-Т) так, чтобы образовавшаяся цепь представляла собой фрагмент РНК:
3. Построить комплементарную цепь к участку одной из цепей ДНК, представленному ниже:
-А - Г - Г - Ц - Т -
: - : - : - : - :
-? - ? - ? - ? - ? -
4.Найдите ошибки в представленном ниже фрагменте ДНК:
-Т - У - А - У - Ц - Т - Т - Г-
: -: - : - : : : : :
А - А - Т - А - Г - А - А - У-
5. Олигонуклеотид гидролизовали двумя способами. В первом случае в гидролизате определили мононуклеотиды А, Г, Ц и Т (последний находится в гидролизате в количестве, превышающем остальные в 2 раза), а также динуклеотиды Г - А, А - Т и Т - Т . Во втором случае, наряду со свободными нуклеотидами нашли динуклеотид Г - Ц .
Определите последовательность нуклеотидов в исходном продукте?
6. Исследуемый раствор обнаруживает положительную биуретовую реакцию, образует осадок при кипячении и добавлении концентрированных минеральных кислот, а также сульфосалициловой кислоты.
Составить план исследования, цель которого - выяснить, находятся в растворе простой или сложный белок. Если обнаружится сложный белок, как установить (или исключить), что он является гемоглобином.
7. Объяснить, на чем основано деление сложных белков на классы.
8. Дать краткую характеристику всех классов сложных белков.
9. Запомнить структурные формулы простетических групп нуклеиновых кислот.
10. Охарактеризовать азотистые основания, входящие в состав нуклеиновых кислот и перечислить различия между ДНК и РНК (по локализации, структуре, функциям).
11. Назвать минимальный информационный элемент в структуре ДНК и РНК.
12. Усвоить, как реализуется роль ДНК и РНК как источников информации.
13. Назвать две подгруппы хромопротеидов и различия между ними.
14. Закрепить представление о структуре гемоглобина (изучить компоненты белковой части и компоненты гема, а также их роль в основной функции гемоглобина).
ЗАНЯТИЕ 4 (итоговое)
При подготовке к итоговому занятию проконтролировать усвоены ли Вами раздел «Строение и функции белков» с помощью следующих вопросов (при подготовке использовать материалы лекций и учебники):
1. Сформулировать понятие «Жизнь», включая в определение все элементы, являющиеся предметом биохимии.
2. Определить предмет биохимии и перечислить вопросы, которыми занимается эта наука.
3. Назвать важнейшие надмолекулярные образования живого и группы молекул, их составляющие
4. Дать определения класса «Белки»
5. Дать определение класса «Аминокислоты».
6. Написать структурные формулы всех трипептидов, которые можно построить из гистидина, аланина и валина.
7. Какие из приведенных ниже пептидов являются кислыми, основными или нейтральными и указать общий электрический заряд каждого из них.pro-ser-ser; ala-pro-leu-thr; met-gly-ala; glu-his-ser; cys-lys-arg, glu-arg-lys; his-glu.
8. Перечислить известные вам подходы к классификации белков
9. Назвать группы белков, различающиеся по составу.
10. Назвать группы белков, различающиеся по трехмерной структуре.
11. Назвать группы сложных белков.
12. Продолжить фразу «Потеря нативной конформации под воздействием химических, физических и других факторов без нарушения аминокислотной последовательности - это.........»
13. Перечислить типы химических связей, разрушающихся при денатурации.
14. Перечислить в логической последовательности действия, необходимые для выделения белков из тканей.
15. Изобразить структурные формулы азотистых оснований, входящих в состав мононуклеотидов.
16. Изобразить структурные формулы АМФ, ГМФ, ЦМФ, ТМФ и УМФ.
17. Изобразить способ связи между мононуклеотидами в полинуклеотиде.
18. Назвать различия между ДНК и РНК по составу, структуре, локализации и функции.
19. К какому типу белков относится гемоглобин?
20. Назвать структурные особенности глобина.
21. Изобразить структурную формулу гема, назвать связи между гемом и глобином.
22. Чем обусловлено многообразие функций белков?
23. Перечислить биологические функции белков.
Тема: «Природа и свойства ферментов» (занятия 5-9)
Цель: изучить химическую природу, функции и свойства биологических катализаторов – ферментов.
Значение темы. Обмен веществ – обязательная и важнейшая особенность живых организмов – слагается из множества разнообразных химических реакций, в которые вовлекаются соединения, поступающие в организм извне и соединения, имеющие эндогенное происхождение. В процессе изучения данного раздела дисциплины усваивается то, что все химические реакции в живом протекают при участии катализаторов, что катализаторы в живом (ферменты или энзимы) являются веществами белковой природы, что свойства ферментов, их поведение зависит от характеристик среды.
При изучении этого раздела приобретаются также сведения о том, как в целостном организме регулируется активность ферментов, и создаются общие представления о связи ряда патологических процессов с изменением активности или количества ферментов, сведения о принципах количественной характеристики ферментов, об их использовании в диагностических и терапевтических целях.